题目内容
O、Si、Al是地壳中含量最多的三种元素,Na、Mg、Cl是海水中的重要元素。下列说法正确的是
A.普通玻璃、水泥成分中都含有O、Si、Al三种元素
B.从海水中制备Na、Mg、Al三种元素单质的反应都是氧化还原反应
C.电解熔融状态的SiO2、Al2O3可以制得Si、Al,且都有氧气生成
D.加热蒸干NaCl、MgCl2溶液时可以得到晶体NaCl、MgCl2
B
【解析】
试题分析:A.普通玻璃的主要成分是Na2SiO3、CaSiO3、SiO2,不含有Mg、Al元素,错误;B.Na、Mg、Al三种元素在海水中都是以化合物的形式存在的,所以由化合物转化为单质的反应一定都是氧化还原反应,正确;C.SiO2是原子晶体,所以在熔融状态无离子存在不能采用电解的方法获得,应该采用焦炭还原的方法制取;而Al2O3可以能采用电解的方法获得制得,但是由于是石墨电极,所以在高温下氧化产生的氧气会与电极发生反应产生CO2,因此不会放出氧气。错误;D.NaCl是强酸强碱盐,加热不水解,因此蒸干可以产生NaCl,而MgCl2是强酸弱碱盐,若将溶液蒸干时得到是Mg(OH)2,错误。
考点:考查物质的元素组成、单质制取原理、及盐的水解的知识。

练习册系列答案
相关题目
 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。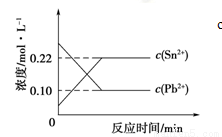



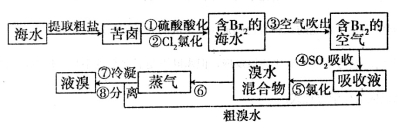
 、OCN
、OCN