题目内容
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
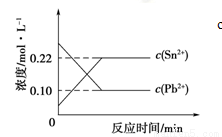
下列判断正确的是
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后, c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应⊿H>0
D.25℃时,该反应的平衡常数K=2.2
D
【解析】
试题分析:A.由于金属活动性顺序是:Sn>Pb,所以往平衡体系中加入金属铅后,不能发生酯化反应,因此c(Pb2+)不变,错误;B.Sn(NO3)2是强酸弱碱盐,水解使溶液显酸性,往平衡体系中加入少量Sn(NO3)2固体后,溶液显酸性,在酸性溶液中H+、NO3-会把Pb氧化为Pb2+,所以 c(Pb2+)变大,错误;C.根据平衡移动原理:升高温度,平衡会向吸热反应方向移动,由于升高温度后,体系中c(Pb2+)增大,说明该反应的逆反应是吸热反应,所以正反应是放热反应,所以⊿H<0,错误; D.25℃时,该反应的平衡常数K=c(Sn2+)/c(Pb2+)=0.22÷0.10=2.2,正确。
考点:考查金属活动性强弱顺序、平衡移动原理的应用、化学平衡常数的计算的知识。

练习册系列答案
相关题目

 ,所属元素的种类是5种
,所属元素的种类是5种