题目内容
(14分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
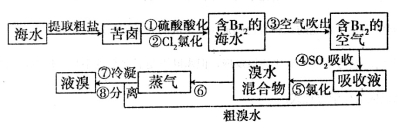
(1)步骤①中用硫酸酸化的目的是____________________________________________。
步骤②发生反应的离子方程式为_____________________________________________。
(2)步骤④利用了SO2的还原性,反应的离子方程式为___________________________。
(3)操作⑥的名称是________________。
(4)从含溴海水中吹出的溴也可用纯碱吸收。纯碱吸收溴的主要反应是:Na2CO3+Br2→NaBrO3+NaBr+CO2,吸收1molBr2时,转移的电子数为________mol。纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出。
(5)化学上将SCN 、OCN
、OCN 、CN
、CN 等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成血红色;通入SO2后,血红色消失。血红色消失过程中发生反应的离子方程式为______________________________________。
等离子称为“类卤离子”。现将KSCN溶液滴加到酸性Fe3+溶液中,溶液立即变成血红色;通入SO2后,血红色消失。血红色消失过程中发生反应的离子方程式为______________________________________。
(14分)
(1)酸化可抑制Cl2、Br2与水反应 (2分);Cl2+2Br-=Br2+2Cl-(2分)
(2)Br2+SO2+2H2O=4H++2Br-+SO42- (3分)
(3)蒸馏 (2分)
(4)5/3 (2分)
(5)2Fe(SCN)3+SO2+2H2O=4H++2Fe2++SO42-+6SCN-(3分)
【解析】
试题分析:(1)氯气、溴单质与水之间能发生可逆反应,生成酸,所以步骤①中用硫酸酸化的目的是:酸化可抑制它们与水的反应;氯气能将溴离子氧化为溴单质,所以步骤②发生反应的离子方程式为:Cl2+2Br-=Br2+2Cl-。
(2)SO2和氯气、水反应生成硫酸和氢溴酸,则离子方程式为:Br2+SO2+2H2O=4H++2Br-+SO42-。
(3)溴水的混合物中,将溴单质和水分离得到溴蒸汽可以采用蒸馏法。
(4)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×1/(1+5)×5=5/3mol。
(5)将KSCN溶液滴加到酸性Fe3+ 溶液中,溶液立即变成血红色;通入SO2后,血红色消失,因为SCN-称为“类卤离子”,根据反应:Br2+SO2+2H2O=4H++2Br-+SO42-,推得,红色消失的过程中发生反应:2Fe(SCN)3+SO2+2H2O=4H++2Fe2++SO42-+6SCN-。
考点:本题考查化学流程的分析、方程式的书写、基本操作、氧化还原反应原理。





 2SO3(g),ΔH=-196 kJ·mol-1。请回答:
2SO3(g),ΔH=-196 kJ·mol-1。请回答: