题目内容
1. 立方氮化硼是一种超硬材料,可由:2Mg3B2N4+3O2 $\frac{\underline{\;\;\;\;\;高温,加热\;\;\;\;\;}}{添加剂,催化剂}$6MgO+4BN+2N2制备.
立方氮化硼是一种超硬材料,可由:2Mg3B2N4+3O2 $\frac{\underline{\;\;\;\;\;高温,加热\;\;\;\;\;}}{添加剂,催化剂}$6MgO+4BN+2N2制备.(1)写出一种与N2互为等电子体的阴离子CN-.
(2)合成立方BN可用Ni-Al、CO(NH2)2等作催化剂.
①Ni2+基态离子核外电子排布式为1s22s22p63s23p63d8.
②1mol CO(NH2)2分子中含有σ的键的数目为7NA.
③依据第2周期元素第一电离能的变化规律,参照图1中B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
(3)立方氮化硼晶胞结构如图2,每个晶胞中含氮原子数为4.
分析 (1)原子数目相等、价电子总数相等的微粒互为电子;
(2)①Ni原子核外电子排布式为1s22s22p63s23p63d84s2,失去4s能级2个电子形成Ni2+;
②单键为σ的键,双键含有1个σ的键,CO(NH2)2分子中含有7个σ的键;
③同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能大于同周期相邻元素的,故第一电离能F>N>O>C>B;
(3)晶胞中N原子处于顶点与面心,利用均摊法计算N原子数目.
解答 解:(1)原子数目相等、价电子总数相等的微粒互为电子,与N2互为等电子体的阴离子为CN-,
故答案为:CN-;
(2)①Ni原子核外电子排布式为1s22s22p63s23p63d84s2,失去4s能级2个电子形成Ni2+,Ni2+基态离子核外电子排布式为1s22s22p63s23p63d8,故答案为:1s22s22p63s23p63d8;
②单键为σ的键,双键含有1个σ的键,CO(NH2)2分子中含有7个σ的键,1mol CO(NH2)2分子中含有σ的键的数目为为7NA,故答案为:7NA;
③同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能大于同周期相邻元素的,故第一电离能F>N>O>C>B,C、N、O三种元素的相对位置为 ,故答案为:
,故答案为: ;
;
(3)晶胞中N原子处于顶点与面心,每个晶胞中含氮原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案为:4.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、化学键、电离能、晶胞计算等,注意同周期第一电离能异常情况.

练习册系列答案
相关题目
11.铝灰的回收利用方法很多,现用含有A12O3、SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O,工艺流程如图:
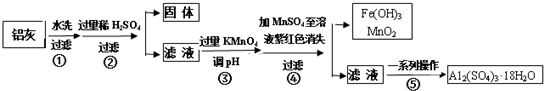
请回答下列问题:
(1)加入过量稀H2SO4溶解A12O3的离子方程式是6H++Al2O3=2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
步骤③的目的是亚铁离子氧化为铁离子,并将铁离子转化为氢氧化铁沉淀除去;若在该浓度下除去铁的化合物,调节pH的最大范围是2.8≤PH<3.4.
(4)已知Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,常温下,当pH=2时,Fe3+开始沉淀的浓度为4.0×10-2mol/L.
(5)操作④发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2+4H+;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是浓盐酸或双氧水.
(6)操作⑤“一系列操作”,下列仪器中用不到的是B (填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.

请回答下列问题:
(1)加入过量稀H2SO4溶解A12O3的离子方程式是6H++Al2O3=2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4=Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol/L的金属阳离子,生成氢氧化物沉淀的pH如表:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(4)已知Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-)=4.0×10-38,常温下,当pH=2时,Fe3+开始沉淀的浓度为4.0×10-2mol/L.
(5)操作④发生反应的离子方程式为2MnO4-+3Mn2++2H2O=5MnO2+4H+;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是浓盐酸或双氧水.
(6)操作⑤“一系列操作”,下列仪器中用不到的是B (填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.
12.等质量的SO2和SO3 中,下列说法正确的是( )
| A. | 所含氧原子的个数比为2:3 | B. | 所含硫原子的个数比为1:1 | ||
| C. | 所含氧元素的质量比为5:6 | D. | 所含硫元素的质量比为5:4 |
9.要使NH4Cl溶液中c(NH4+)=c(Cl-),可向其中加入( )
| A. | NH3•H2O | B. | 盐酸 | C. | H2SO4 | D. | CH3COONa |
16.氯化溴(BrCl)和Br2、Cl2具有相似的性质,下列有关氯化溴性质的判断中不正确的是( )
| A. | 在CCl4中的溶解性Cl2<BrCl<Br2 | |
| B. | BrCl氧化性比Br2强 | |
| C. | BrCl能使润湿的淀粉碘化钾试纸变蓝 | |
| D. | 常温下BrCl可与NaOH溶液反应生成NaClO和NaBr |
10.中华民族有着光辉灿烂的发明创造史,下列古代的技术应用中不涉及化学反应的是( )
| A. | 烧结粘土制陶瓷 | B. | 湿法炼铜 | C. | 海水晒盐 | D. | 粮食酿酒 |
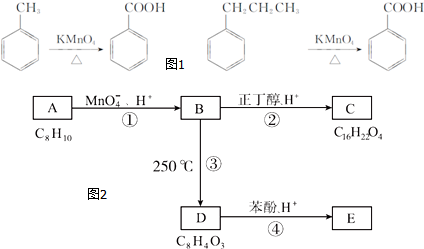
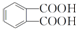 .
.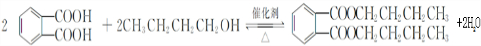 ,该反应的类型为取代反应.
,该反应的类型为取代反应.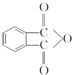 ,在D物质的核磁共振氢谱图中,会出现2组峰,峰面积之比为1:1.
,在D物质的核磁共振氢谱图中,会出现2组峰,峰面积之比为1:1.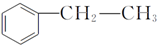 (写结构简式).
(写结构简式).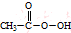 (过氧乙酸)+H2O
(过氧乙酸)+H2O