题目内容
10.中华民族有着光辉灿烂的发明创造史,下列古代的技术应用中不涉及化学反应的是( )| A. | 烧结粘土制陶瓷 | B. | 湿法炼铜 | C. | 海水晒盐 | D. | 粮食酿酒 |
分析 A.制陶瓷的原料是粘土,生成硅酸盐产品;
B.湿法炼铜有新物质铜生成;
C.海水晒盐没有新物质生成;
D.用粮食酿酒过程中有新物质酒精生成.
解答 解:A.制陶瓷的原料是粘土,发生化学变化生成硅酸盐产品,故A正确;
B.湿法炼铜有新物质铜生成,属于化学变化,故B正确;
C.海水晒盐没有新物质生成,不涉及化学反应,故C错误;
D.用粮食酿酒过程中有新物质酒精生成,属于化学变化,故D正确.
故选C.
点评 本题考查物理变化与化学变化的区别与联系,难度不大,解答时要分析变化过程中是否有新物质生成,这里的新物质是指和变化前的物质是不同种的物质,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.若实验室仅有锥形瓶、长颈漏斗、导管、胶管、烧杯、药匙,据此只能制备下列哪组气体( )
| A. | C2H2、H2S、C2H4 | B. | H2、CO2、H2S | C. | HCl、CO2、O2 | D. | H2、NO2、CH4 |
18.四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题.
(1)Z在元素周期表中位于ⅣA族.
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是Na(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是bc(填序号).
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH═NaN3+H2O,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.

能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y.
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是Na(填元素符号).
(3)①下列可作为比较X和Y金属性强弱的依据是bc(填序号).
a.自然界中的含量
b.相应氯化物水溶液的pH
c.单质与水反应的难易程度
d.单质与酸反应时失去的电子数
②从原子结构的角度解释X的金属性强于Y的原因:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al.
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似.体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是HN3+NaOH═NaN3+H2O,混合后溶液中离子浓度由大到小的顺序是c(Na+)>c(N3-)>c(OH-)>c(H+).
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数.

能确定混合物中Y的质量分数的数据有abc(填序号).
a.m、n b.m、y c.n、y.
5.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 煤炭经过干馏,石油经分馏、裂化、裂解化工处理,可获得清洁能源和重要的化工原料 | |
| B. | 比能量低而笨重的铅蓄电池使用时电压不稳定,所以有被其他新型电池取代的趋势 | |
| C. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料单晶硅也可以制备电脑芯片 |
19.下列用电子式表示的形成过程正确的是( )
| A. | 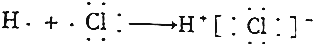 | |
| B. | 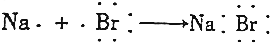 | |
| C. | 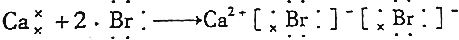 | |
| D. | 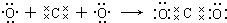 |
 立方氮化硼是一种超硬材料,可由:2Mg3B2N4+3O2 $\frac{\underline{\;\;\;\;\;高温,加热\;\;\;\;\;}}{添加剂,催化剂}$6MgO+4BN+2N2制备.
立方氮化硼是一种超硬材料,可由:2Mg3B2N4+3O2 $\frac{\underline{\;\;\;\;\;高温,加热\;\;\;\;\;}}{添加剂,催化剂}$6MgO+4BN+2N2制备.


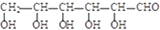 碱性条件下氧化为
碱性条件下氧化为 .
.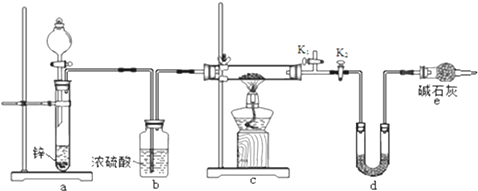
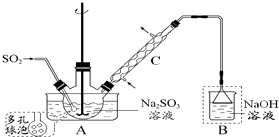 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得: