题目内容
9.材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础.(1)合金是生活中常见的材料.某合金具有密度小、强度高的优良性能,常用于制造门窗框架.该合金中含量最高的金属为Al(填元素符号).
(2)铁锈的主要成分是Fe2O3•xH2O(或Fe2O3)(填化学式),它是钢铁在潮湿的空气中发生电化学(或吸氧)腐蚀的结果.防止金属腐蚀的措施有刷漆、镀层等(写出一条即可).
(3)玻璃是一种常见的硅酸盐材料.制备普通玻璃的原料有CaCO3、Na2CO3和SiO2(填化学式)
分析 (1)根据该金属常用于制造门窗框架,其合金具有密度小、强度高的优良性能,可知为铝;
(2)铁锈的主要成分是氧化铁;钢铁在空气中发生电化学腐蚀时为吸氧腐蚀,铁易失电子发生氧化反应而作负极,碳作正极,正极上氧气得电子发生还原反应;通常采用的防止发生腐蚀方法有:改变金属内部组织结构、在金属表面覆盖保护层和电化学保护法;
(3)生产玻璃的原料是纯碱、石灰石和石英.
解答 解:(1)铝合金:铝中加入镁、铜、锌等金属形成合金,具有密度小、强度高的优良性能常用于制造门窗框架,故答案为:Al;
(2)铁在空气中与氧气、水共同作用而生锈,铁锈的主要成分是铁的氧化物氧化铁;钢铁在空气中发生电化学腐蚀时为吸氧腐蚀,铁易失电子发生氧化反应而作负极,负极上电极反应式为:Fe-2e-═Fe2+,碳作正极,正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-═4OH-,防止金属腐蚀的方法有很多种,如:改变金属内部组织结构,如合金,在金属表面覆盖保护层,如:在铁制品表面涂矿物性油、油漆或烧制搪瓷、喷塑等,还可以利用电化学保护法,如将金属与外加电源的负极相连等,故答案为:Fe2O3•xH2O(或Fe2O3);电化学(或吸氧);刷漆、镀层等;
(3)生产玻璃的原料是纯碱、石灰石和石英;石英砂的主要成分是二氧化硅,与碳酸钙反应生成硅酸钙和二氧化碳,与碳酸钠反应生成硅酸钠和二氧化碳,故答案为:Na2CO3;SiO2.
点评 本题考查金属铝、铁、硅酸盐等知识,题目难度不大,注意掌握金属腐蚀的原理、类型,明确防止金属腐蚀的方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
20.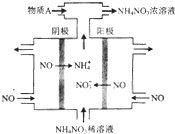 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.
(1)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是:根据反应:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2?)和c(CH3COO?)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据.
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为0.15mol/(L.min);n3=n4(填“>”、“<”或“=”),该反应的平衡常数的值为2.8.
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是0.1mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为60%.
 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.(1)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3,理由是:根据反应:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,电解产生的硝酸多,需补充NH3.
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2?)和c(CH3COO?)由大到小的顺序为c(NO3-)>c(NO2-)>c(CH3COO-)(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L).可使溶液A和溶液B的pH相等的方法是bc.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g)?N2O4(g)△H<0.每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据.
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是0.1mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为60%.
17.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | Na2O2与水反应时,1 mol Na2O2转移1 mol电子 | |
| B. | 78gNa2O2含有阴、阳离子总数是4NA | |
| C. | 1mo1•L-1的AlC13溶液中,C1-离子的数目为3 NA | |
| D. | 5.6 g铁与足量盐酸反应转移的电子数为0.3 NA |
14.已知热化学方程式:2A(g)+B(g)?2C(g)△H=-QkJ•mol-1(Q>0).下列说法正确的是( )
| A. | 相同条件下,2molA(g)和1molB(g)所具有的总能量小于2mol C(g)所具有的能量 | |
| B. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| C. | 将2molA(g)和1molB(g)置于一密闭容器中充分反应后,放出热量为QkJ | |
| D. | 如将一定量A(g)和B(g)置于某密闭容器中充分反应放热Q kJ,则此过程中有2molA(g)被消耗 |
1.下列反应中,过氧化钠既不作氧化剂也不作还原剂的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | |
| B. | 2Na2O2+2CO2═2NaCO3+O2 | |
| C. | Na2O2+H2SO4(稀)═Na2SO4+H2O2 | |
| D. | Fe2O3+3Na2O2(熔融)═2Na2FeO4十Na2O |
18.下列离子方程式正确的是( )
| A. | 向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH${\;}_{4}^{+}$+Al3++2SO${\;}_{4}^{2-}$+2Ba2++5OH-═AlO+2BaSO4↓+NH3•H2O+2H2O | |
| B. | 工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2═Ca2++ClO-+Cl-+H2O | |
| C. | 制备Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
19.下列离子能大量共存的是( )
| A. | Na+、H+、NO3-、CO32- | B. | Na+、Fe3+、I-、SO42- | ||
| C. | K+、Cu2+、SO42-、OH- | D. | Na+、Fe3+、NO3-、Cl- |