题目内容
19.13C-NMR(核磁共振)可用于含碳化合物的结构分析14N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是( )| A. | 15N与14N互为同位素 | B. | 13C与14C互为同素异形体 | ||
| C. | 13C与15N具有相同的中子数 | D. | 15N的核外电子数与中子数相同 |
分析 A.具有相同的质子数,不同的中子数的原子,互为同位素;
B.同种元素形成的不同单质互为同素异形体;
C.根据中子数=质量数-质子数进行计算;
D.根据核外电子数=质子数,中子数=质量数-质子数进行计算.
解答 解:A.15N与14N的质子数相同,中子数不同,故互为同位素,故A正确;
B.13C与14C都是碳原子,不是单质,互为同位素,故B错误;
C.13C的中子数=13-6=7,15N的中子数=15-7=8,中子数不同,故C错误;
D.15N的核外电子数=质子数=7,中子数=15-7=8,核外电子数与中子数不相同,故D错误;
故选A.
点评 本题考查同位素的概念及粒子间的数量关系,难度不大.要注意对于原子而言:核外电子数=质子数,中子数=质量数-质子数,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
10.下列各种叙述中正确的是( )
| A. | 在CH2=CH2分子中,存在4个σ键和一个π键 | |
| B. | NH3、CO、CS2都是极性分子 | |
| C. | N、O、F电负性大小:F>O>N;第一电离能大小:N>F>O | |
| D. | H2O的沸点比HF的沸点高,是由于水中氢键键能大 |
7.从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4═3Br2+3Na2SO4+3H2O,与该反应在氧化还原反应原理上最相似的是( )
| A. | 2NaBr+Cl2═2NaCl+Br2 | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 2H2S+SO2═2H2O+3S↓ | |
| D. | C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 |
14.下列说法中错误的是( )
| A. | 所有的非金属元素都分布在p区 | |
| B. | 元素周期表中ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 在同一主族中,自上而下第一电离能逐渐减小 | |
| D. | 第ⅠA、ⅡA族元素的原子,其半径越大,电负性越小 |
4.下列有关物质用途的说法中,正确的是( )
①单质锗是良好的半导体材料;
②Fe3O4常用于红色油漆和涂料;
③液氨可用于制冷剂;
④SO2可用来漂白馒头、银耳等食品;
⑤纯净的二氧化硅是制备光导纤维的原料;
⑥水玻璃可用于木材防火.
①单质锗是良好的半导体材料;
②Fe3O4常用于红色油漆和涂料;
③液氨可用于制冷剂;
④SO2可用来漂白馒头、银耳等食品;
⑤纯净的二氧化硅是制备光导纤维的原料;
⑥水玻璃可用于木材防火.
| A. | ①②③⑤⑥ | B. | ①③⑥ | C. | ①③⑤⑥ | D. | ③⑤⑥ |
8.某白色粉末由两种物质组成,为鉴别共成分进行如下实验:
①取少量样品加入足量水完全溶解;再加入足量氢氧化钠溶液(微热),产生白色沉淀并有气泡冒出.
②取少量样品加入足量稀盐酸有气泡产生,振荡后固体完全溶解.
该白色粉末可能为( )
①取少量样品加入足量水完全溶解;再加入足量氢氧化钠溶液(微热),产生白色沉淀并有气泡冒出.
②取少量样品加入足量稀盐酸有气泡产生,振荡后固体完全溶解.
该白色粉末可能为( )
| A. | NaHCO3、MgC12 | B. | NH4HCO3、AlC13 | C. | (NH4)2CO3、BaCl2 | D. | NH4HCO3、MgC12 |
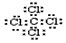 ,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.
,用一个离子方程式证明S(硫)元素和U元素的非金属性的强弱S2-+Cl2=S+2Cl-或H2S+Cl2=2H++2Cl-+S.