��Ŀ����
9��������E��һ��ҽҩ�м��壬�������Ʊ�����Ѫҩ������ͨ����ͼ��ʾ��·�ߺϳɣ�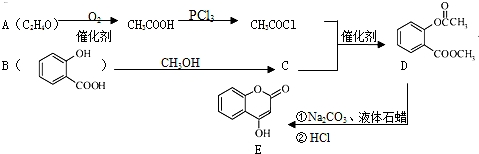
��1��B�к��еĺ�������������Ϊ�ǻ����Ȼ���
��2��Cת��ΪD�ķ�Ӧ������ȡ����Ӧ��
��3��д��D������NaOH��Һ��ȫ��Ӧ�Ļ�ѧ����ʽ
 ��
����4��1molE������4molH2�ӳɣ�
��5��д��ͬʱ��������������B��һ��ͬ���칹��Ľṹ��ʽ
 ��
��A���ܷ���������Ӧ
B���˴Ź�������ֻ��4����
C������FeCl3��Һ������ɫ��Ӧ��ˮ��ʱ1mol������3molNaOH
��6����֪��ҵ�����ȱ�ˮ����ȡ���ӣ������ǻ�һ�㲻��ֱ���������������ױ��ɱ����Ը��������Һ����Ϊ�����ᣮ�����ᱽ������
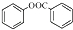 ����һ����Ҫ���л��ϳ��м��壮��д���Ա����ױ�Ϊԭ����ȡ�û�����ĺϳ�·������ͼ����ԭ����ѡ�����ϳ�·������ͼʾ�����£�
����һ����Ҫ���л��ϳ��м��壮��д���Ա����ױ�Ϊԭ����ȡ�û�����ĺϳ�·������ͼ����ԭ����ѡ�����ϳ�·������ͼʾ�����£�H2C�TCH2$\stackrel{HBr}{��}$CH3CH2Br$��_{��}^{NaOH��Һ}$CH3CH2OH��
���� �ɺϳ����̿�֪��AΪCH3CHO��BΪ���ǻ������ᷢ��������Ӧ����C��CΪ ��C��CH3COCl����ȡ����Ӧ����D��D�к�-COOC-���ܷ���ˮ�ⷴӦ��Dˮ���ữ������������Ӧ����E���Ա����ױ�Ϊԭ����ȡ�����ᱽ�����������ñ�����������ȡ�������ȱ�����ˮ��ñ��ӣ��üױ������ñ����ᣬ�����������Ȼ�����ȡ���ñ������ȣ����������뱽�ӷ���ȡ����Ӧ���ɱ����ᱽ�������ݴ˴��⣮
��C��CH3COCl����ȡ����Ӧ����D��D�к�-COOC-���ܷ���ˮ�ⷴӦ��Dˮ���ữ������������Ӧ����E���Ա����ױ�Ϊԭ����ȡ�����ᱽ�����������ñ�����������ȡ�������ȱ�����ˮ��ñ��ӣ��üױ������ñ����ᣬ�����������Ȼ�����ȡ���ñ������ȣ����������뱽�ӷ���ȡ����Ӧ���ɱ����ᱽ�������ݴ˴��⣮
��� �⣺�ɺϳ����̿�֪��AΪCH3CHO��BΪ���ǻ������ᷢ��������Ӧ����C��CΪ ��C��CH3COCl����ȡ����Ӧ����D��D�к�-COOC-���ܷ���ˮ�ⷴӦ��Dˮ���ữ������������Ӧ����E��
��C��CH3COCl����ȡ����Ӧ����D��D�к�-COOC-���ܷ���ˮ�ⷴӦ��Dˮ���ữ������������Ӧ����E��
��1������B�Ľṹ��ʽ��֪��B�к��еĺ���������Ϊ�ǻ����Ȼ���
�ʴ�Ϊ���ǻ����Ȼ���
��2��������������֪��C�е�-OH�ϵ�H��ȡ������Cת��ΪD�ķ�Ӧ������ȡ����Ӧ���ʴ�Ϊ��ȡ����Ӧ��
��3��D������NaOH��Һ��ȫ��Ӧ�Ļ�ѧ����ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��4��E�к�������C=C�����������������ӳɷ�Ӧ����1Ħ��E������4molH2�ӳɣ��ʴ�Ϊ��4��
��5��BΪ���ǻ������ᣬ��ͬ���칹����ϣ�
A���ܹ�����������Ӧ����-CHO��
B���˴Ź�������ֻ��4���壬��4��λ�õ�H��
C������FeCl3��Һ������ɫ��Ӧ������-OH��ˮ��ʱÿĦ��������3Ħ��NaOH����-COOCH������ͬ���칹��Ϊ ��
��
�ʴ�Ϊ�� ��
��
��6���Ա����ױ�Ϊԭ����ȡ�����ᱽ�����������ñ�����������ȡ�������ȱ�����ˮ��ñ��ӣ��üױ������ñ����ᣬ�����������Ȼ�����ȡ���ñ������ȣ����������뱽�ӷ���ȡ����Ӧ���ɱ����ᱽ�������ϳ�����ͼΪ ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���л���ĺϳɣ�Ϊ�߿����������ͣ�ע����պϳ������еķ�Ӧ��������֪��Ϣ���ƶϸ����ʣ���Ϥ�л���Ľṹ�����ʼ��ɽ����Ŀ�Ѷ��еȣ�

| A�� | Z���۵�ϸ� | B�� | Z���Ա�ʾΪM2Y | ||
| C�� | Z����������ˮ | D�� | M�γ�+2�۵������� |
| A�� | Ϊ�ӳ�ʳƷ�����ڣ��������д������ӱ������Ƶȷ����� | |
| B�� | ��ת��������β��Ϊ�����壬����������������ķ��� | |
| C�� | PM2.5��ָ�����е���������������ﺬ��֮�� | |
| D�� | ����Ƥ������Ϊԭ�������ֽ������Ҫ�ɷ�����ά�أ�����ά������۲���ͬ���칹�� |
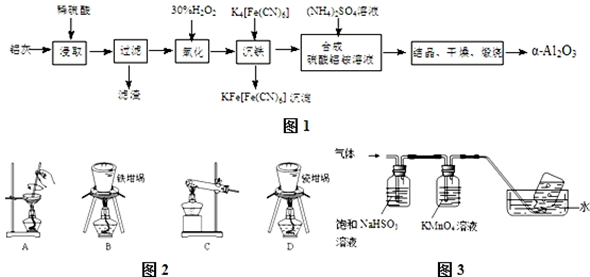
 ��
�� ��
��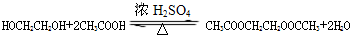 ��
��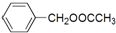 �����е�һ�֣������Դ���������ȡ��Ҳ�����üױ����Ҵ�Ϊԭ�Ͻ����˹��ϳɣ�һ�ֺϳ�·�����£�
�����е�һ�֣������Դ���������ȡ��Ҳ�����üױ����Ҵ�Ϊԭ�Ͻ����˹��ϳɣ�һ�ֺϳ�·�����£�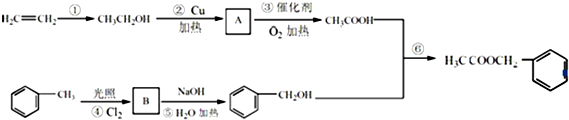
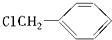 ��
��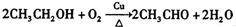 ��
��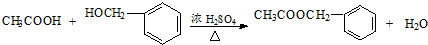 ��
��