题目内容
11.将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配位数是4的配合离子,请写出生成此配合离子的离子方程式:Cu2++4H2O═[Cu(H2O)4]2+.分析 配位数:中心原子周围的配位原子个数,硫酸铜溶于水,生成了一种呈蓝色的配位数是4的配合离子,铜离子与水生成了呈蓝色的配合离子[Cu(H2O)4]2+,据此书写离子反应方程式.
解答 解:将白色的无水CuSO4溶解于H2O中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,中心离子是Cu2+,配体为H2O,配位数为4,生成此配合离子的离子方程式:Cu2++4H2O=[Cu(H2O)4]2+,
故答案为:Cu2++4H2O=[Cu(H2O)4]2+.
点评 本题主要考查了配合物的组成,配体、中心离子、外界离子以及配位数的判断是解题的关键,题目难度不大.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
19.在2L恒容绝热(不与外界交换能量)容器中进行2A(g)+B(g)?2C(g)+D(s)反应,按下表数据投料,反应10s后达到平衡状态,测得体系压强升高,前10s内v(A)=0.025mol/(L•s).下列说法正确的是( )
| 物质 | A | B | C | D |
| 起始投料(mol) | 2 | 1 | 2 | 0 |
| A. | 该反应的△H>0 | B. | 温度升高,该反应的平衡常数减小 | ||
| C. | 到达平衡时,n(B)=0.5 mol | D. | 平衡后,增加D的量,平衡逆向移动 |
2.要鉴别己烯中是否混有少量甲苯,最好的方法是( )
| A. | 先加入足量的高锰酸钾溶液,然后再加溴水 | |
| B. | 加入浓硫酸和浓硝酸后再加热 | |
| C. | 先加入足量的溴水,然后再加入高锰酸钾酸性溶液 | |
| D. | 点燃这种液体,然后再观察火焰的明亮程度 |
19.M元素的一个原子失去两个电子并转移到Y元素的两个原子中,形成离子化合物Z,下列 说法不正确的是( )
| A. | Z的熔点较高 | B. | Z可以表示为M2Y | ||
| C. | Z可能易溶于水 | D. | M形成+2价的阳离子 |

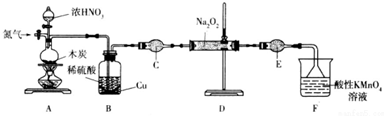
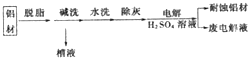
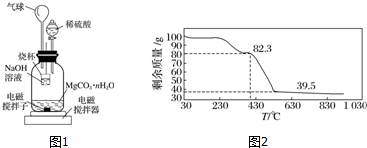
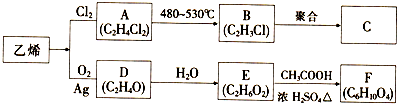
 .
.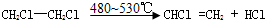 ;
;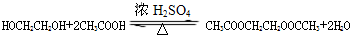 .
.