题目内容
 (1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是
(1)稀释0.1mol?L-1氨水时,随着水量的增加而减小的是①
| c(NH3?H2O) |
| c(OH-) |
| c(OH-) |
| c(H+) |
(2)pH相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是
①反应所需的时间B>A ②开始反应时的速率A>B ③参加反应的锌粉物质的量A=B
④反应过程中的平均速率 B>A ⑤A溶液里有锌粉剩余 ⑥B溶液里有锌粉剩余
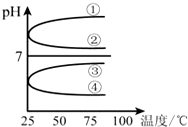
(3)将等体积、等物质的量浓度的氨水和盐酸混合后,升高温度(溶质不会分解)溶液的pH随温度变化是图中的
(4)室温下,向0.01mol?L-1NH4HSO4溶液中滴加0.01mol?L-1NaOH溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为
(5)25℃,将a mol?L-1的氨水与0.0lmol?L-l的盐酸等体积混合,反应达平衡时溶液中c(NH4+)=c(Cl-).则溶液显
考点:弱电解质在水溶液中的电离平衡
专题:
分析:(1)用水稀释0.1mol/L氨水时,溶液中随着水量的增加,由NH3.H2O OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少;
OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少;
(2)pH相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余;
(3)等体积、等物质的量浓度的氨水和盐酸混合后恰好生成氯化铵溶液,铵根离子水解显酸性,加热促进水解;
(4)向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH;
(5)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3?H2O的电离常数Kb=
.
 OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少;
OH-+NH4+可知,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,加水促进电离,则n(NH3.H2O)减少;(2)pH相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余;
(3)等体积、等物质的量浓度的氨水和盐酸混合后恰好生成氯化铵溶液,铵根离子水解显酸性,加热促进水解;
(4)向 NH4HSO4中滴加NaOH溶液,当二者物质的量相同时,c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH;
(5)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3?H2O的电离常数Kb=
| c(OH-).c(NH4+) |
| c(NH3.H2O) |
解答:
解:(1)①由NH3.H2O OH-+NH4+可知,加水促进电离,则c(NH3.H2O)减少,c(OH-)减小,平衡正向移动,所以NH3.H2O分子减小的程度大,
OH-+NH4+可知,加水促进电离,则c(NH3.H2O)减少,c(OH-)减小,平衡正向移动,所以NH3.H2O分子减小的程度大,
减小,故正确;
②由NH3.H2O OH-+NH4+可知,加水促进电离,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,c(H+)和c(OH-)的乘积不变,则c(H+)增大,所以
OH-+NH4+可知,加水促进电离,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,c(H+)和c(OH-)的乘积不变,则c(H+)增大,所以
减小,故正确;
③因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故错误;
④由NH3.H2O OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故错误;
OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故错误;
故答案为:①②;
(2)pH相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余;
①由于醋酸中酸过量,则反应较快,所以反应所需的时间A>B;故错误;
②开始pH相同,则氢离子浓度相同,所以开始时反应速率A=B,故错误;
③由于生成的氢气体积相同,所以参加反应的锌粉物质的量A=B,故正确;
④醋酸的浓度大于盐酸的浓度,则醋酸中反应速率大,所以反应过程中的平均速率 B>A,故正确;
⑤醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故正确;
⑥醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故错误;
故答案:③④⑤;
(3)等体积、等物质的量浓度的氨水和盐酸混合后恰好生成氯化铵溶液,NH4+水解溶液显酸性,PH<7,①②pH大于7,故①②错误;
加热促进水解,加热水解平衡向右移动,c(H+)增大,酸性增强,PH减小,③错误、④正确,
故答案为:④;
(4)NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3?H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42- )>c(NH4+),则溶液中所有离子的物质的量浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
(5)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3?H2O的电离常数Kb=
=
=
;
故答案为:中;
.
 OH-+NH4+可知,加水促进电离,则c(NH3.H2O)减少,c(OH-)减小,平衡正向移动,所以NH3.H2O分子减小的程度大,
OH-+NH4+可知,加水促进电离,则c(NH3.H2O)减少,c(OH-)减小,平衡正向移动,所以NH3.H2O分子减小的程度大,| c(NH3?H2O) |
| c(OH-) |
②由NH3.H2O
 OH-+NH4+可知,加水促进电离,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,c(H+)和c(OH-)的乘积不变,则c(H+)增大,所以
OH-+NH4+可知,加水促进电离,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,c(H+)和c(OH-)的乘积不变,则c(H+)增大,所以| c(OH-) |
| c(H+) |
③因加水稀释时,温度不变,则c(H+)和c(OH-)的乘积不变,故错误;
④由NH3.H2O
 OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故错误;
OH-+NH4+可知,加水促进电离,OH-的物质的量增大,故错误;故答案为:①②;
(2)pH相同的等体积的A、B两份溶液(A为盐酸,B为醋酸)分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余;
①由于醋酸中酸过量,则反应较快,所以反应所需的时间A>B;故错误;
②开始pH相同,则氢离子浓度相同,所以开始时反应速率A=B,故错误;
③由于生成的氢气体积相同,所以参加反应的锌粉物质的量A=B,故正确;
④醋酸的浓度大于盐酸的浓度,则醋酸中反应速率大,所以反应过程中的平均速率 B>A,故正确;
⑤醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故正确;
⑥醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故错误;
故答案:③④⑤;
(3)等体积、等物质的量浓度的氨水和盐酸混合后恰好生成氯化铵溶液,NH4+水解溶液显酸性,PH<7,①②pH大于7,故①②错误;
加热促进水解,加热水解平衡向右移动,c(H+)增大,酸性增强,PH减小,③错误、④正确,
故答案为:④;
(4)NH4HSO4中滴入NaOH溶液,NaOH首先与NH4HSO4电离出的H+作用,因为H+结合OH-的能力比NH4+结合OH-的能量强(原因是产物H2O比NH3?H2O更难电离).当加入等摩尔的NaOH时,正好将H+中和,此时c(Na+)=c(SO42-),但此时溶液中还有NH4+,NH4+水解使溶液呈酸性,因此要使溶液呈中性,则还需继续滴入NaOH,当然到中性时c(OH-)=c(H+),c(Na+)>c(SO42- )>c(NH4+),则溶液中所有离子的物质的量浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
故答案为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+);
(5)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得n(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3?H2O的电离常数Kb=
| c(OH-).c(NH4+) |
| c(NH3.H2O) |
| 10-7×5×10-3 |
| 0.5a-5×10-3 |
| 10-9 |
| a-0.01 |
故答案为:中;
| 10-9 |
| a-0.01 |
点评:本题考查电解质溶液之间的反应,涉及到强电解质、弱电解质的电离、盐类的水解及溶液的pH值、离子浓度大小的比较、电离平衡常数的计算等知识,题目涉及的知识点较多,综合性较强,题目难度中等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
某溶液中含有1.2×10-3mol XO3-,恰好能氧化30mL 0.1mol/L亚硫酸钠溶液,则还原产物中元素X的化合价是?( )
| A、0? | B、-2 | C、+1 | D、+2 |
结构决定性质:如最外层电子数决定元素性质,“官能团”是决定有机物性质的原子或原子团.下列原子团不是有机“官能团”的是( )
| A、-CH3 |
| B、-CHO |
| C、-COOH |
| D、-OH |
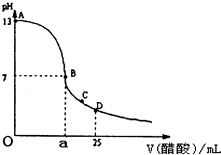 如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:
如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答: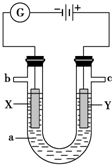 如图表示一个电解池,装有电解液a;X、Y是两块电极板通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板通过导线与直流电源相连.请回答以下问题: 对如图的解读不正确的是( )
对如图的解读不正确的是( )