题目内容
12.下列有关说法正确的是( )| A. | Al2O3和Na2O按物质的量比1:1投人水中可得到澄清溶液 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | Na2O2、FeO、Fe2O3均是碱性氧化物 | |
| D. | SiO2既能和氢氧化钠溶液反应又能和氢氟酸反应,所以是两性氧化物 |
分析 A、Al2O3和Na2O按物质的量比1:1,设各自的物质的量都为1mol,1mol的氧化钠与水反应生成2mol的氢氧化钠,而1mol的氧化铝与2mol的氢氧化钠恰好完全反应生成偏铝酸钠;
B、氢氧化铁胶体为红褐色液体;
C、过氧化钠与酸反应生成盐与氧气;
D、两性氧化物是指:既能与酸又能与碱反应,只生成盐和水的氧化物.
解答 解:A、Al2O3和Na2O按物质的量比1:1,设各自的物质的量都为1mol,1mol的氧化钠与水反应生成2mol的氢氧化钠,而1mol的氧化铝与2mol的氢氧化钠恰好完全反应生成偏铝酸钠,所以Al2O3和Na2O按物质的量比1:1投人水中可得到澄清溶液,故A正确;
B、氢氧化铁胶体为红褐色液体,透明,能发生丁达尔现象,故B错误;
C、过氧化钠与酸反应生成盐与氧气,所以过氧化钠不是碱性氧化物,故C错误;
D、氢氟酸与二氧化硅反应生成四氟化硅和水,不符合两性氧化物的定义,不是两性氧化物,故D错误;
故选A.
点评 本题考查了元素化合物知识,熟悉二氧化硅的性质是解题关键,注意两性氧化物的概念,题目难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
14.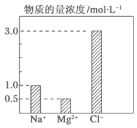 在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是( )
在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是( )
 在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是( )
在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是( )| A. | 0.5 mol | B. | 1.0 mol | C. | 2.0 mol | D. | 3.0 mol |
17.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘和酒精 | B. | 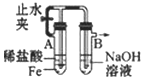 较长时间观察Fe(OH)2白色沉淀 | ||
| C. | 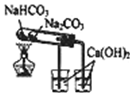 验证NaHCO3和Na2CO3的热稳定性 | D. | 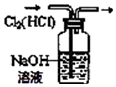 除去Cl2中HCl |

 铁、铝及其化合物在生产和生活中有着广泛的应用.
铁、铝及其化合物在生产和生活中有着广泛的应用.