题目内容
2.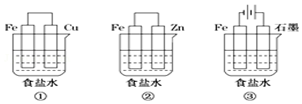 铁、铝及其化合物在生产和生活中有着广泛的应用.
铁、铝及其化合物在生产和生活中有着广泛的应用.(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是①(填装置序号),该装置中正极电极反应式为O2+2H2O+4e-=4OH-;为防止金属Fe被腐蚀,可以采用上述②③(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-.
(2)新型固体LiFePO4隔膜电池广泛应用于电动汽车.电池反应为FePO4+Li?LiFePO4,电解质为含Li+的导电固体,且充、放电时电池内两极间的隔膜只允许Li+自由通过而导电.该电池放电时Li+向正极移动(填“正”或“负”),负极反应为Li-e-═Li+,则正极反应式为FePO4+Li++e-=LiFePO4.
分析 (1)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;
(2)原电池中阳离子移向正极;依据总反应方程式和负极电极反应计算得到正极电极反应式.
解答 解:(1))①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;①组装置中铁电极腐蚀最快;正极反应是氧气得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-;②③装置中铁被保护;装置③中发生的是电解饱和食盐水的反应,阳极是氯离子失电子生成氯气,阴极是氢离子得到电子发生还原反应,反应离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-;
故答案为:①; O2+2H2O+4e-=4OH-;②③; 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-;
(2)FePO4+Li?LiFePO4 放电过程是原电池,锂离子带正电荷,向着原电池的正极移动;总反应方程式减去负极反应得到正极电极反应:FePO4+Li++e-=LiFePO4,
故答案为:正;FePO4+Li++e-=LiFePO4.
点评 本题考查较为综合,涉及金属腐蚀与防护、原电池工作原理等知识,题目难度中等,注意掌握原电池、电解池工作原理,明确常见金属腐蚀与防护方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
12.下列有关说法正确的是( )
| A. | Al2O3和Na2O按物质的量比1:1投人水中可得到澄清溶液 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | Na2O2、FeO、Fe2O3均是碱性氧化物 | |
| D. | SiO2既能和氢氧化钠溶液反应又能和氢氟酸反应,所以是两性氧化物 |
13.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 2g H2含有的氢原子数目为NA | |
| B. | 常温常压下,22.4L O2含有的分子数目为NA | |
| C. | 1mol•L-1KOH溶液中含有的钾离子数目为NA | |
| D. | 6.5gl Zn变为Zn2+时失去的电子数目0.2NA |
10.下列物质既能与盐酸反应,又能与烧碱溶液反应的是( )
①Al2O3 ②Al ③Al(OH)3 ④NaHCO3⑤Fe(OH)3 ⑥SiO2 ⑦(NH4)2CO3 ⑧CaCO3.
①Al2O3 ②Al ③Al(OH)3 ④NaHCO3⑤Fe(OH)3 ⑥SiO2 ⑦(NH4)2CO3 ⑧CaCO3.
| A. | 除⑥外 | B. | 除⑤.⑥.⑦外 | C. | ①.②.③.④.⑦ | D. | ①.③.⑥.⑧ |
7.用价层电子对互斥模型判断NH4+的构型是( )
| A. | V形 | B. | 正四面体形 | C. | 三角锥形 | D. | 平面三角形 |
14.下列有关化学用语表示正确的是( )
| A. | -CHO的电子式: | B. | 丙烷分子的比例模型为: | ||
| C. | 2-乙基-1,3-丁二烯的键线式: | D. | 对硝基甲苯的结构简式: |
11.陕西省考古研究院工作人员将出土的秦墓铜鼎和铜钟打开时,惊奇的发现,鼎内有保存完好的骨头汤,钟内有酒.经检测,骨头汤中含有大量的蛋白质和动物脂肪,酒中含有乙醇、乙酸和乙酸乙酯.下列说法中正确的是( )
| A. | 淀粉、油脂、蛋白质都是高分子化合物 | |
| B. | 淀粉、油脂、蛋白质的水解产物互为同分异构体 | |
| C. | 油脂通过皂化反应生成肥皂的有效成分高级脂肪酸钠 | |
| D. | 酒中含有乙酸,是因为乙醇长期放置在空气中,在微生物作用下“酒败成醋” |
16.下列有关海水综合利用的说法正确的是( )
| A. | 海水晒盐后的母液中,直接加入CCl4可萃取Br2单质 | |
| B. | 从海水制海盐主要是通过化学变化完成 | |
| C. | 电解氯化钠溶液可以制得钠单质和氯气 | |
| D. | 电解熔融的氯化镁可制备镁单质和氯气 |
 如图所示,
如图所示,