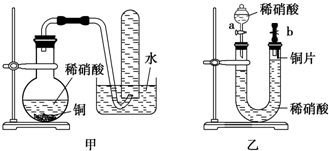
题目内容
5.一定质量的镁铝合金与某浓度的硝酸恰好完全反应,得硝酸盐溶液和NO2、N2O4、NO的混合气体,将这些气体与标准状况下3.36L氧气混合后通入水中,所有气体恰好完全被水吸收生成硝酸.若向所得硝酸盐溶液中加入2mol/L NaOH溶液至沉淀最多时停止加入,则所加NaOH溶液的体积为( )| A. | 100 mL | B. | 200 mL | C. | 300 mL | D. | 400 mL |
分析 金属失去的电子等于氧气与混合气体反应生成硝酸获得的电子,向所得硝酸盐溶液中加入4mol/LNaOH溶液至沉淀最多停止加入,此时溶液为硝酸钠溶液.根据硝酸根守恒可知,钠离子物质的量等于金属失去的电子的物质的量.据此计算NaOH的物质的量,进而计算溶液的体积.
解答 解:标准状况下3.36L氧气的物质的量=$\frac{3.36L}{22.4L/mol}$=0.15mol,所以氧气获得电子的物质的量为0.15mol×4=0.6mol;
金属失去的电子等于氧气与混合气体反应生成硝酸获得的电子,为0.6mol,
向所得硝酸盐溶液中加入2mol/LNaOH溶液至沉淀最多停止加入,此时溶液为硝酸钠溶液.根据硝酸根离子守恒可知,钠离子物质的量等于金属失去的电子的物质的量为0.6mol.则NaOH为0.6mol,所以V(NaOH)=$\frac{0.6mol}{2mol/L}$=0.3L=300mL.
故选:C.
点评 本题考查了氧化还原反应的有关计算,如果利用常规方考虑每个细节的反应将无法解答,根据守恒思想来从总体上分析,再结合转移电子守恒、原子守恒解答,题目难度较大,注意守恒思想的运用.

练习册系列答案
相关题目
3.A、B、C、D为四种短周期主族元素,且原子序数依次增大.已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法正确的是( )
| A. | 原子半径:C>A | |
| B. | 离子半径:D3+>B2- | |
| C. | 非金属性:A>B | |
| D. | 最高价氧化物对应水化物的碱性:C<D |
1.绿色化学是从源头上防止污染产生或将化学过程对环境的负面影响降低到最低限度的化学.不仅化工生产应遵循绿色化学的原则,化学实验也遵循绿色化学原则,实现原料和过程的绿色化.下列实验或实验过程遵循绿色化学原则的是( )
| A. | 用双氧水代替高锰酸钾制氧气 | |
| B. | 用多量的氯气进行性质实验 | |
| C. | 用溴水代替碘水进行萃取实验 | |
| D. | 用铜粉代替铜丝进行铜和浓硝酸的反应 |
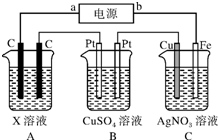 如图所示,电解一段时间后,测得C中Ag+减少了0.1mol,Fe电极被溶解.试回答:
如图所示,电解一段时间后,测得C中Ag+减少了0.1mol,Fe电极被溶解.试回答:
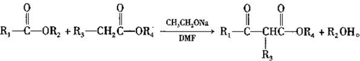
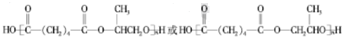 ,1中官能团的名称酯基和羰基.
,1中官能团的名称酯基和羰基.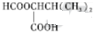 .
.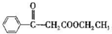 写出合成路线图.
写出合成路线图.