题目内容
形成下列事实的原理相同的是( )
| A、NH4Cl溶液和HCl溶液的pH均小于7 |
| B、苯酚和氢氧化钠溶液在空气中久置均会变质 |
| C、铁片和铝片置于冷的浓硫酸中均无明显现象 |
| D、二氧化硫通入氯化钡溶液至饱和,再加入硝酸或苛性钠溶液都能产生白色沉淀 |
考点:盐类水解的应用,二氧化硫的化学性质,浓硫酸的性质,铁的化学性质,苯酚的化学性质
专题:基本概念与基本理论,元素及其化合物
分析:A、NH4Cl溶液水解呈酸性和HCl溶液电离呈酸性;
B、苯酚在空气中因氧化而变质和氢氧化钠溶液会变质是与空气中的二氧化碳反应而变质;
C、铁片和铝片置于冷的浓硫酸都发生钝化,而无明显现象;
D、将SO2通入氯化钡溶液至饱和,再加入足量硝酸或苛性钠溶液,分别生成硫酸钡和亚硫酸钡沉淀.
B、苯酚在空气中因氧化而变质和氢氧化钠溶液会变质是与空气中的二氧化碳反应而变质;
C、铁片和铝片置于冷的浓硫酸都发生钝化,而无明显现象;
D、将SO2通入氯化钡溶液至饱和,再加入足量硝酸或苛性钠溶液,分别生成硫酸钡和亚硫酸钡沉淀.
解答:
解:A、NH4Cl溶液水解呈酸性和HCl溶液电离呈酸性,二者原理不同,故A不选;
B、苯酚在空气中因氧化而变质和氢氧化钠溶液会变质是与空气中的二氧化碳反应而变质,二者原理不同,故B不选;
C、铁片和铝片置于冷的浓硫酸都发生钝化,而无明显现象,二者原理相同,故C选;
D、将SO2通入氯化钡溶液至饱和,再加入足量硝酸,亚硫酸被氧化为硫酸,生成硫酸钡沉淀,而加入苛性钠溶液,生成亚硫酸钡沉淀,二者原理不同,故D不选;
故选C.
B、苯酚在空气中因氧化而变质和氢氧化钠溶液会变质是与空气中的二氧化碳反应而变质,二者原理不同,故B不选;
C、铁片和铝片置于冷的浓硫酸都发生钝化,而无明显现象,二者原理相同,故C选;
D、将SO2通入氯化钡溶液至饱和,再加入足量硝酸,亚硫酸被氧化为硫酸,生成硫酸钡沉淀,而加入苛性钠溶液,生成亚硫酸钡沉淀,二者原理不同,故D不选;
故选C.
点评:本题考查较为综合,难度中等,注意D为易错点,学习中要注意积累相关元素化合物知识.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
电解下列哪种物质的水溶液相当于电解水的是( )
| A、H2SO4 |
| B、NaCl |
| C、CuSO4 |
| D、HCl |
下列实验设计方案中,可行的是( )
| A、向某无色溶液中仅加入AgNO3溶液,以检验未知溶液中的Cl- | ||
| B、用洗气瓶中的NaOH溶液除去CO2气体中混有的HCl气体 | ||
C、向某无色溶液中仅加入BaCl2溶液,以检验未知溶液中的SO
| ||
| D、用加入适量铜粉的方法除去Cu(NO3)2溶液中的AgNO3杂质 |
下列关系正确的是( )
| A、沸点:苯酚>甲醛>2一甲基丁烷 |
| B、2,2,3,3-四甲基丁烷、新戊烷、乙烷中化学环境相同的H原子种类由多到少 |
| C、密度:溴苯>H2O>苯 |
| D、等物质的量物质燃烧耗O2量:己烷>苯>C6H5COOH |
在密闭容器中,对于反应2SO2(g)+O2(g)?2SO3(g),SO2和O2起始时分别为2.0mol和1.0mol;达平衡时,SO2的转化率为80%.若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起起始时SO3的物质的量及其转化率为( )
| A、1.0 mol和 10% |
| B、2.0 mol和 80% |
| C、2.0 mol和 40% |
| D、2.0 mol和 20% |
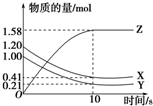 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是( )| A、反应开始到10s,用Z表示的反应速率为0.158mol/(L?s) |
| B、反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C、达平衡时Y的物质的量分数为:9.5% |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |