题目内容
用下列实验装置完成对应的实验,不能达到实验目的是( )
| A | B | C | D | |
| 装置 | 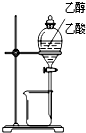 | 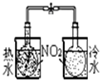 | 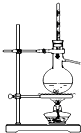 |  |
| 实验 | 分离乙醇和乙酸 | 证明温度对化学平衡的影响 | 分离沸点相差较大的互溶液体混合物 | 制取并收集氨气 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.乙醇和乙酸混溶,不能用分液的方法分离;
B.已知2NO2?N2O4 △H<0,根据颜色的变化判断;
C.分离沸点相差较大的互溶液体混合物,可用蒸馏的方法;
D.氨气密度比空气小,用向下排空法收集,注意防止倒吸.
B.已知2NO2?N2O4 △H<0,根据颜色的变化判断;
C.分离沸点相差较大的互溶液体混合物,可用蒸馏的方法;
D.氨气密度比空气小,用向下排空法收集,注意防止倒吸.
解答:
解:A.乙醇和乙酸混溶,不能用分液的方法分离,应用蒸馏的方法分离,故A错误;
B.已知2NO2?N2O4△H<0,根据颜色的变化可知平衡移动的方向,以此可确定温度对平衡移动的影响,故B正确;
C.沸点不同的液体混合物,当沸点相差较大时,可用蒸馏的方法分离,故C正确;
D.氨气密度比空气小,用向下排空法收集,氨气不溶于四氯化碳,可防止倒吸,故D正确.
故选A.
B.已知2NO2?N2O4△H<0,根据颜色的变化可知平衡移动的方向,以此可确定温度对平衡移动的影响,故B正确;
C.沸点不同的液体混合物,当沸点相差较大时,可用蒸馏的方法分离,故C正确;
D.氨气密度比空气小,用向下排空法收集,氨气不溶于四氯化碳,可防止倒吸,故D正确.
故选A.
点评:本题考查较为综合,涉及物质制备、分离、物质的鉴别、化学平衡移动等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
形成下列事实的原理相同的是( )
| A、NH4Cl溶液和HCl溶液的pH均小于7 |
| B、苯酚和氢氧化钠溶液在空气中久置均会变质 |
| C、铁片和铝片置于冷的浓硫酸中均无明显现象 |
| D、二氧化硫通入氯化钡溶液至饱和,再加入硝酸或苛性钠溶液都能产生白色沉淀 |
今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略).某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变):
下列结论正确的是( )
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 100 | 100 | 100 | 100 |
| 混合粉末质量/g | 6 | 13.2 | 24 | 36 |
| 反应后剩余固体质量/g | 0 | 1.28 | 12.8 | 24.8 |
| A、第①组溶液中c(Fe3+)=3.0mol/L |
| B、第②组剩余固体是铁和铜 |
| C、第④组反应后的滤液中c(Fe2+)=6mol/L |
| D、原混合粉末中n(Fe):n(Cu)=3:2 |
把5.1g铝镁合金的粉末放入100mL某盐酸中,恰好完全反应得到5.6L H2(标准状况下).试计算:
(1)上述反应过程中,转移电子的物质的量;
(2)该盐酸的物质的量浓度;
(3)该合金中铝的质量分数.
(1)上述反应过程中,转移电子的物质的量;
(2)该盐酸的物质的量浓度;
(3)该合金中铝的质量分数.
aX(g)+bY(g)?cZ(g)+dW(g)在一定容积的密闭容器中反应,5min时达到平衡,X减少 n mol?L-1,Y减少
mol?L-1,Z增加
mol?L-1.若将体系压强增大,W的百分含量不发生变化.则化学方程式中各物质的化学计量数之比a:b:c:d应为( )
| n |
| 3 |
| 2n |
| 3 |
| A、3:1:2:1 |
| B、1:3:2:2 |
| C、1:3:1:2 |
| D、3:1:2:2 |
 一种新型锅炉水添加剂的分子结构如图所示,该添加剂能除去锅炉水中溶解的氧气.下列有关说法正确的是( )
一种新型锅炉水添加剂的分子结构如图所示,该添加剂能除去锅炉水中溶解的氧气.下列有关说法正确的是( )| A、该添加剂与尿素[CO(NH2)2]互为同系物 |
| B、分子中各原子的最外层均达到八电子稳定结构 |
| C、分子中所有原子共平面 |
| D、该添加剂具有还原性 |
 将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.请回答: 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(实验1中CO2的体积为标准状况下,其它气体在同温同压下测定).
如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(实验1中CO2的体积为标准状况下,其它气体在同温同压下测定). 


