题目内容
LiBH4为近年来储氢材料领域的研究热点.
(1)反应2LiBH4═2LiH+2B+3H2↑,生成22.4L H2(标准状况)时,转移电子的物质的量为 mol.
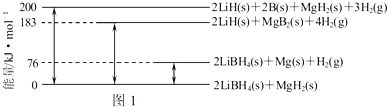
(2)如图1是2LiBH4/MgH2体系放氢焓变示意图,则:Mg(s)+2B(s)═MgB2(s)△H= .
(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图2为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图.由图2可知,下列说法正确的是 (填字母).
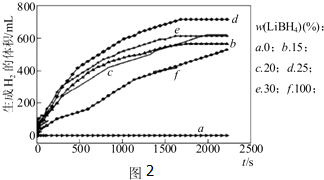
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如图3为25℃和75℃时,Al-LiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).
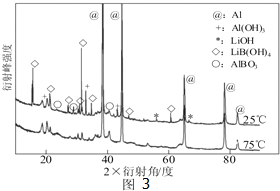
从如图3分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式),产生Al(OH)3的化学方程式为 .
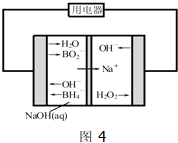
(4)如图4是直接硼氢化钠-过氧化氢燃料电池示意图.该电池工作时,正极附近溶液的pH (填“增大”、“减小”或“不变”),负极的电极反应式为 .
(1)反应2LiBH4═2LiH+2B+3H2↑,生成22.4L H2(标准状况)时,转移电子的物质的量为
(2)如图1是2LiBH4/MgH2体系放氢焓变示意图,则:Mg(s)+2B(s)═MgB2(s)△H=

(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图2为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图.由图2可知,下列说法正确的是

a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如图3为25℃和75℃时,Al-LiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).

从如图3分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是
(4)如图4是直接硼氢化钠-过氧化氢燃料电池示意图.该电池工作时,正极附近溶液的pH

考点:镁、铝的重要化合物,反应热和焓变,常见化学电源的种类及其工作原理
专题:基本概念与基本理论,元素及其化合物
分析:(1)反应2LiBH4═2LiH+2B+3H2↑,可知生成3mol的氢气转移6mol的电子,则生成22.4L H2(标准状况)时,也就是产生1mol的氢气,转移电子的物质的量为2mol;
(2)应用盖斯定律,来解答;
(3)①a.因为由图LiBH4含量为0时,氢气的体积为0,故25℃时,纯铝与水不反应,;
b.负一价的氢与正一价的氢发生归中反应生成氢气,LiBH4+4H2O=LiB(OH)4+4H2↑;
c.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小;
②如图3中无LiBH4,说明与水完全反应,根据质量守恒中的元素守恒,不可能产生氢氧化铝,所以氢氧化铝是铝与水反应得到的;
(4)如图4正极是阳离子流向的一极,即过氧化钠所在的一极,发生还原反应,负一价的氧得电子生成氧负离子,跟水结合成氢氧根离子,溶液的pH增大,负极发生还原反应,注意是碱性介质.
(2)应用盖斯定律,来解答;
(3)①a.因为由图LiBH4含量为0时,氢气的体积为0,故25℃时,纯铝与水不反应,;
b.负一价的氢与正一价的氢发生归中反应生成氢气,LiBH4+4H2O=LiB(OH)4+4H2↑;
c.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小;
②如图3中无LiBH4,说明与水完全反应,根据质量守恒中的元素守恒,不可能产生氢氧化铝,所以氢氧化铝是铝与水反应得到的;
(4)如图4正极是阳离子流向的一极,即过氧化钠所在的一极,发生还原反应,负一价的氧得电子生成氧负离子,跟水结合成氢氧根离子,溶液的pH增大,负极发生还原反应,注意是碱性介质.
解答:
解:(1)反应2LiBH4═2LiH+2B+3H2↑,可知生成3mol的氢气转移6mol的电子,则生成22.4L H2(标准状况)时,也就是产生1mol的氢气,转移电子的物质的量为2mol,故答案为:2;
(2)由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ?mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ?mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ?mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ?mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ?mol-1④
所以-④-②得:Mg(s)+2B(s)═MgB2(s)△H=-(17+76)kJ?mol-1
故答案为:-93 kJ?mol-1;
(3)①a.25℃时,纯铝与水不反应,因为由图LiBH4含量为0时,氢气的体积为0,故选;
b.25℃时,纯LiBH4与水反应产生氢气,负一价的氢与正一价的氢发生归中反应生成氢气,故选;
c.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小,故不选;
故答案为:ab;
②如图3中无LiBH4,说明与水完全反应,根据质量守恒中的元素守恒,不可能产生氢氧化铝,所以氢氧化铝是铝与水反应得到的)2Al+6H2O═2Al(OH)3+3H2↑,
故答案为:LiBH4;2Al+6H2O═2Al(OH)3+3H2↑;
(4)如图4正极是阳离子流向的一极,即过氧化钠所在的一极,发生还原反应,负一价的氧得电子生成氧负离子,跟水结合成氢氧根离子,溶液的pH增大,负极发生还原反应,注意是碱性介质,电极反应式为:BH4--8e-+8OH-═BO2-+6H2O,故答案为:增大;BH4--8e-+8OH-═BO2-+6H2O.
(2)由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ?mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ?mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ?mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ?mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ?mol-1④
所以-④-②得:Mg(s)+2B(s)═MgB2(s)△H=-(17+76)kJ?mol-1
故答案为:-93 kJ?mol-1;
(3)①a.25℃时,纯铝与水不反应,因为由图LiBH4含量为0时,氢气的体积为0,故选;
b.25℃时,纯LiBH4与水反应产生氢气,负一价的氢与正一价的氢发生归中反应生成氢气,故选;
c.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小,故不选;
故答案为:ab;
②如图3中无LiBH4,说明与水完全反应,根据质量守恒中的元素守恒,不可能产生氢氧化铝,所以氢氧化铝是铝与水反应得到的)2Al+6H2O═2Al(OH)3+3H2↑,
故答案为:LiBH4;2Al+6H2O═2Al(OH)3+3H2↑;
(4)如图4正极是阳离子流向的一极,即过氧化钠所在的一极,发生还原反应,负一价的氧得电子生成氧负离子,跟水结合成氢氧根离子,溶液的pH增大,负极发生还原反应,注意是碱性介质,电极反应式为:BH4--8e-+8OH-═BO2-+6H2O,故答案为:增大;BH4--8e-+8OH-═BO2-+6H2O.
点评:本题考查元素化合物知识,涉及热化学方程式的书写,盖斯定律的应用,电化学知识,综合性非常强,难度大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组离子在溶液中能大量共存的是( )
| A、Al3+、Na+、HCO3-、[Al(OH)4]- |
| B、Ca2+、HCO3-、Cl-、K+ |
| C、Fe3+、H+、SO42-、S2- |
| D、Fe2+、NO3-、Na+、H+ |
下列说法正确的是( )
| A、同周期的IA族元素的金属性比IIA族的元素金属性强 |
| B、第三周期元素的阴离子半径从左到右逐渐增大 |
| C、VIA族的气态氢化物一定比VA族的稳定性强 |
| D、原子晶体的熔点一定比离子晶体的高 |
一定条件下,铁与水蒸气反应除生成H2外,还生成的化合物是( )
| A、Fe2O3 |
| B、FeO |
| C、Fe(OH)3 |
| D、Fe3O4 |
在标准状况下,1mol二氧化碳的体积约为( )
| A、28L | B、11.2L |
| C、22.4L | D、5.6L |