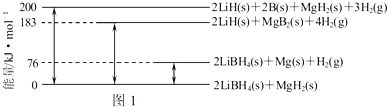
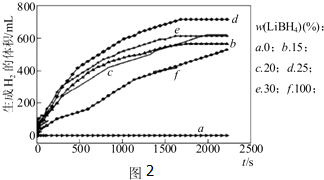
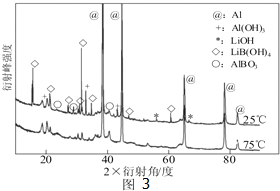
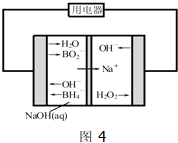
题目内容
下列说法正确的是( )
| A、同周期的IA族元素的金属性比IIA族的元素金属性强 |
| B、第三周期元素的阴离子半径从左到右逐渐增大 |
| C、VIA族的气态氢化物一定比VA族的稳定性强 |
| D、原子晶体的熔点一定比离子晶体的高 |
考点:同一周期内元素性质的递变规律与原子结构的关系,同一主族内元素性质递变规律与原子结构的关系,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.同周期,从左向右金属性减弱;
B.第三周期元素的阴离子,具有相同电子层结构,原子序数大的离子半径小;
C.非金属性越强,气态氢化物越稳定;
D.一般来说,原子晶体中共价键作用力大于离子晶体中离子键的作用力.
B.第三周期元素的阴离子,具有相同电子层结构,原子序数大的离子半径小;
C.非金属性越强,气态氢化物越稳定;
D.一般来说,原子晶体中共价键作用力大于离子晶体中离子键的作用力.
解答:
解:A.由元素周期律可知,同周期的IA族元素的金属性比IIA族的元素金属性强,故A正确;
B.第三周期元素的阴离子,具有相同电子层结构,则第三周期元素的阴离子半径从左到右逐渐减小,故B错误;
C.非金属性越强,气态氢化物越稳定,如N的非金属性大于S,则VIA族的气态氢化物不一定比VA族的稳定性强,故C错误;
D.原子晶体的熔点一般比离子晶体的高,但有的离子晶体的熔点较高,如氧化铝,可能比某些原子晶体熔点高,故D错误;
故选A.
B.第三周期元素的阴离子,具有相同电子层结构,则第三周期元素的阴离子半径从左到右逐渐减小,故B错误;
C.非金属性越强,气态氢化物越稳定,如N的非金属性大于S,则VIA族的气态氢化物不一定比VA族的稳定性强,故C错误;
D.原子晶体的熔点一般比离子晶体的高,但有的离子晶体的熔点较高,如氧化铝,可能比某些原子晶体熔点高,故D错误;
故选A.
点评:本题考查同主族、同周期元素性质及元素化合物性质,为高频考点,把握同主族、同周期的位置关系及非金属性比较为解答的关键,选项D为易错点,注意特例应用,题目难度不大.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
洗涤做过银镜反应的试管,最好选用下列试剂中的( )
| A、浓氨水 | B、盐酸溶液 |
| C、稀硝酸溶液 | D、浓烧碱溶液 |
某短周期元素原子最外层有2个电子,则( )
| A、一定是ⅡA族元素 |
| B、其最外层电子已形成了稳定结构 |
| C、一定是镁元素 |
| D、可能是氦元素或ⅡA族元素 |
2013年10月21日清晨,哈尔滨出现重度雾霾天气,一些市区能见度已不足50米,全市中小学停课,部分公交线路暂时停止运营,多条高速公路全线封闭,“PM2.5”数据监测纳入哈尔滨公众视野.“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物.下列有关说法中,错误的是( )
| A、雾霾有可能产生丁达尔现象 |
| B、近来雾霾的形成与工业排放的烟气、汽车尾气排放、秸秆焚烧有关系 |
| C、“PM2.5”没有必要纳入空气质量评价指标 |
| D、雾霾天气严重危害人体健康 |
下列离子方程式正确的是( )
| A、铝与稀盐酸反应 Al+2H+=Al3++H2↑ |
| B、三氯化铁溶液与氢氧化钠溶液反应 FeCl3+3OH-=Fe(OH)3↓+3Cl- |
| C、用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
| D、二氧化碳与石灰水反应 CO2+2OH-=CO32-+H2O |
 如图表示反应:N2(g)+3H2(g)?2NH3(g) (正反应是放热反应)在某一时间段内反应速率与反应过程的曲线关系图.则氨的百分含量最高的一段时间是( )
如图表示反应:N2(g)+3H2(g)?2NH3(g) (正反应是放热反应)在某一时间段内反应速率与反应过程的曲线关系图.则氨的百分含量最高的一段时间是( )| A、t0---t1 |
| B、t2----t3 |
| C、t3---t4 |
| D、t5----t6 |
下列说法正确的是( )
| A、同温同压下甲烷和氧气的密度之比为2:1 |
| B、1 g甲烷和1 g氧气的原子数之比为5:1 |
| C、等物质的量的甲烷和氧气的质量之比为2:1 |
| D、在标准状况下等质量的甲烷和氧气的体积之比为1:2 |