题目内容
2.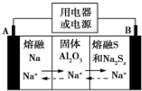 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体 Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体 Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 电子流向:A电极→用电器→B电极→电解质→A 电极 | |
| B. | 充电时,电极B与外接电源正极相连,电极反应式为Sx2--2e-=xS | |
| C. | 若用该电池在铁器上镀锌,则铁器应与B电极相连接 | |
| D. | 若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g |
分析 根据图片知,放电时,Na失电子发生氧化反应,所以A作负极、B作正极,负极反应式为2Na-2e-═2Na+、正极反应式为xS+2e-═Sx2-,充电时A为阳极、B为阴极,阴极、阳极电极反应式与负极、正极反应式正好相反,放电时,电解质中阳离子向正极移动、阴离子向负极移动.
解答 解:A、电解质中电子不能通过,故A错误;
B、充电时,电极B与外接电源正极相连,发生氧化反应,电极反应式为Sx2--2e-=xS,故B正确;
C、镀件作为阴极,所以铁器应与A电极相连接,故C错误;
D、电解法精炼铜时,粗铜作阳极,发生的反应有:Zn-2e-=Zn2+,Fe-2e-=Fe2+,Ni-2e-=Ni2+,Cu-2e-=Cu2+,可见每转移1mol电子时阳极上溶解的铜必小于32 g,故D错误.
故选B.
点评 本题考查化学电源新型电池,正确获取图片提供信息是解本题关键,根据得失电子确定正负极、阴阳极,难点是电极反应式的书写,题目难度中等.

练习册系列答案
相关题目
12.下列叙述正确的是( )
| A. | 卤素的氢化物中沸点最低的是HF | |
| B. | 因为H2O分子间有氢键,所以H2O比H2S稳定 | |
| C. | 一个X原子的质量为ag,则X元素的相对原子质量为aNA | |
| D. | 熔沸点:NH3<PCl3 |
10.下列各组混合物,不能用分液漏斗分开的是( )
①CCl4和水②乙醇和甘油③乙醛和水④苯和水⑤己烷和水⑥环己烷和苯⑦溴苯和水.
①CCl4和水②乙醇和甘油③乙醛和水④苯和水⑤己烷和水⑥环己烷和苯⑦溴苯和水.
| A. | ①②③ | B. | ②③⑥ | C. | ①④⑤⑦ | D. | ④⑤⑥ |
17.历史上最早应用的还原性染料是靛蓝,其结构简式如下图.下列关于靛蓝的叙述中错误的是( ) 

| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 该物质不属于烃 | D. | 它是不饱和烃 |
7.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原于核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素的电离能数据如下表; D元素的电负性是同周期元素中最大的; F原子最外层电子数与B的相同,其余各层均充满电子.
请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)B和D形成的化合物的熔点比C和D形成的化合物的熔点高(填“高”或“低”),理由是NaCl为离子晶体而AlCl3为分子晶体;冶炼C单质时加入的降低熔点的物质中含有的化学键类型有离子键、共价键、配位键(填“离子键”或“共价键”或“配位键”)
(2)E的价电子排布图为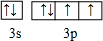 ,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
(3)碳元素与E形成的化合物是极性键形成的非极性分子(填“极性”或“非极性”);其中碳原子的杂化方式为sp,该分子中含有σ键和π键的数目之比为1:1.
(4)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为AlN,其晶体中所含的化学键类型为共价键.
| 各级电离能 | 电离能数值kJ/mol |
| 第一电离能 | 578 |
| 第二电离能 | 1817 |
| 第三电离能 | 2745 |
| 第四电离能 | 11575 |
| 第五电离能 | 14830 |
| 第六电离能 | 18376 |
(1)B和D形成的化合物的熔点比C和D形成的化合物的熔点高(填“高”或“低”),理由是NaCl为离子晶体而AlCl3为分子晶体;冶炼C单质时加入的降低熔点的物质中含有的化学键类型有离子键、共价键、配位键(填“离子键”或“共价键”或“配位键”)
(2)E的价电子排布图为
 ,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
,E的最高价氧化物对应的水化物的浓溶液与F的单质反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.(3)碳元素与E形成的化合物是极性键形成的非极性分子(填“极性”或“非极性”);其中碳原子的杂化方式为sp,该分子中含有σ键和π键的数目之比为1:1.
(4)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为AlN,其晶体中所含的化学键类型为共价键.
14.以下食品化学知识的叙述不正确的是( )
| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | 新鲜蔬菜做熟后,所含维生素C会有损失 | |
| C. | 浓硫酸可刻蚀石英制艺术品 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂 |
17.下列有关实验的叙述中错误的是( )
| A. | 在蒸馏装置中,温度计水银球的位置在蒸馏烧瓶的支管口处. | |
| B. | “苯甲酸的重结晶”实验步骤是:加热溶解---趁热过滤---冷却结晶---滤出晶体 | |
| C. | 在萃取实验中,溶质在萃取剂中的溶解度小于在原溶剂中的溶解度 | |
| D. | 在过滤实验中,应做到“一贴,二低,三靠” |
 .
.