题目内容
13.向盛有400mL某浓度稀HNO3的大烧杯中加入Wg铁粉,充分反应后,铁粉质量减少16.8g,再往烧杯中加入V mL 4mol•L-1的稀硫酸,充分反应后,铁粉质量又减少8.4g,此时铁粉仍有剩余,(假设稀HNO3只被还原为NO)(1)写出题中铁粉与稀HNO3反应的离子方程式3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,通过计算得出所用的稀HNO3的物质的量浓度为2mol•L-1,加稀H2SO4之前,溶液中剩余的NO3-的物质的量为0.6mol.
(2)加入4mol•L-1的稀硫酸的体积V=50mL
(3)若硫酸足量,要使反应有H2产生,W的取值范围是W>67.2.
分析 (1)稀HNO3只被还原为NO,Fe粉有剩余,则Fe与稀硝酸反应生成硝酸亚铁、NO与水;
消耗16.8g Fe时,溶液中HNO3完全反应,根据3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O计算HNO3、Fe(NO3)2的物质的量,进而计算原硝酸的浓度、加稀H2SO4之前溶液中剩余的NO3-的物质的量;
(2)加入硫酸发生反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,结合消耗的Fe计算氢离子物质的量,可得加入硫酸的物质的量,进而计算硫酸溶液的体积;
(3)硝酸根完全转化为NO后,Fe有剩余,剩余的Fe与硫酸反应生成氢气,结合原溶液中硝酸根离子物质的量、离子方程式计算.
解答 解:(1)稀HNO3只被还原为NO,Fe粉有剩余,则Fe与稀硝酸反应生成硝酸亚铁、NO与水,反应离子方程式为:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,
消耗16.8g Fe的物质的量为$\frac{16.8g}{56g/mol}$=0.3mol,则:
3 Fe+8 HNO3=3 Fe(NO3)2+2NO↑+4H2O
3 8 3
0.3mol 0.8mol 0.3mol
所用的稀HNO3的物质的量浓度为$\frac{0.8mol}{0.4L}$=2mol•L-1,加稀H2SO4之前,溶液中剩余的NO3-的物质的量为0.3mol×2=0.6mol,
故答案为:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;2;0.6;
(2)加入硫酸后又溶解Fe的物质的量为$\frac{8.4g}{56g/mol}$=0.15mol,
3 Fe+2 NO3-+8 H+=3Fe2++2NO↑+4H2O
3 8
0.15mol n(H+)
n(H+)=$\frac{0.15mol×8}{3}$=0.4mol,
则加入硫酸的物质的量为$\frac{0.4mol}{2}$=0.2mol,故加入4mol•L-1的稀硫酸的体积V=$\frac{0.2mol}{4mol/L}$=0.05L=50mL,
故答案为:50mL;
(3)硝酸根完全转化为NO后,Fe有剩余,剩余的Fe与硫酸反应生成氢气,设硝酸根完全转化为NO时消耗Fe为xmol,则:
3 Fe+2 NO3-+8H+=3Fe2++2NO↑+4H2O
3 2
xmol 0.8mol
所以3:2=xmol:0.8mol,解得x=1.2,故Fe的质量应大于1.2mol×56g/mol=67.2g,即W>67.2,
故答案为:W>67.2.
点评 本题考查混合物计算、化学方程式有关计算,关键是明确发生的反应,侧重考查学生分析计算能力,容易认为加入VmL硫酸时硝酸根完全反应,而导致错误答案.

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
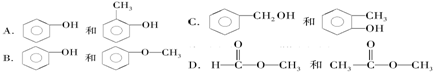
课课优能力培优100分系列答案| A. | 亚硫酸钠 | B. | 氢氧化钠 | C. | 过氧化钠 | D. | 碳酸氢钠 |
| A. | 碳碳单键(CC) | B. | 碳碳双键(CC) | C. | 碳碳三键(-C≡C-) | D. | 碳氢键(CH) |
| A. | 石油裂解目的是为了提高轻质油产量和质量 | |
| B. | 淀粉、纤维素、油脂都是高分子化合物 | |
| C. | 可以通过分液的方法分离乙酸乙酯和水的混合物 | |
| D. | 在紫外线、饱和(NH4)2SO4溶液、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性 |
| A. | $\frac{m(b-a-3)}{b}$ | B. | $\frac{(b-a-3)}{mb}$ | C. | $\frac{m(b-a)}{b}$ | D. | $\frac{m(b-a+3)}{b}$ |
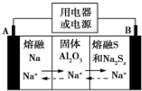 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体 Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体 Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示.下列说法正确的是( )| A. | 电子流向:A电极→用电器→B电极→电解质→A 电极 | |
| B. | 充电时,电极B与外接电源正极相连,电极反应式为Sx2--2e-=xS | |
| C. | 若用该电池在铁器上镀锌,则铁器应与B电极相连接 | |
| D. | 若用该电池电解精炼铜,电路中转移1mol电子时,阳极质量减少32 g |
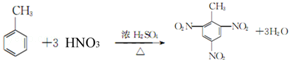
 汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:
汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=-283kJ•moL-1.几种化学键的键能数据如下:
| 化学键 | N≡N键 | O=O键 | N$\stackrel{←}{=}$O键 |
| 键能kJ/•mol-1 | 945 | 498 | 630 |
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后电解质溶液中离子浓度大小顺序为
c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),则负极的反应式为2CO-2e-+3OH-=HCO3-+H2O;
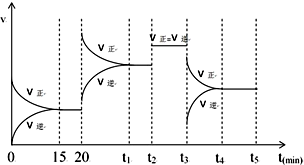
(3)在一定温度下,向2L的密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应
4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0,相关数据如下:
| 0min | 5min | 10min | 15min | 20min | |
| c(NO2) | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2) | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②能说明上述反应达到平衡状态的是BD
A.2n正(NO2)=n逆(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变D.容器内气体压强不变
③20min时,向容器中加入1.0molNO2和1.0molCO,在t1时刻再次达到平衡时,NO2的转化率比原平衡时变大(填“变大”、“变小”或“不变”).
④计算此温度下的化学平衡常数K=0.11
⑤在上述平衡的基础上,在时间t2、t3时改变反应的某一条件,反应速率的变化如图所示,则在t3时刻改变的反应条件是:降低温度;在时间15-20,t1-t2,t2-t3,t4-t5时的平衡常数分别为K1、K2、K3、K4,请比较各平衡常数的大小关系:K1=K2=K3<K4.
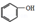 (制酚醛树脂)④
(制酚醛树脂)④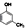 (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)