题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、遇苯酚显紫色的溶液:I-、AlO2-、SCN-、Mg2+ |
| B、pH=12的溶液:AlO2-、ClO-、SO32-、Na+ |
| C、含较多Al3+离子的溶液:Na+、NO3-、S2-、AlO2- |
| D、pH=2的HNO3溶液:Na+、Ag+、NO3-、NH4+ |
考点:离子共存问题
专题:离子反应专题
分析:离子之间不生成气体、沉淀、弱电解质、络合物、不发生氧化还原反应、不发生双水解反应的就能共存,据此分析解答.
解答:
解:A.溶液遇苯酚显紫色说明溶液中含有电离Fe3+,Fe3+和SCN-生成络合物而不能大量共存,故A错误;
B.ClO-和SO32-易发生氧化还原反应而不能共存,故B错误;
C.含有较多多Al3+离子的溶液说明溶液呈酸性,酸性条件下,NO3-和S2-发生氧化还原反应而不能共存,故C错误;
D.这几种离子之间不反应,所以能共存,故D正确;
故选D.
B.ClO-和SO32-易发生氧化还原反应而不能共存,故B错误;
C.含有较多多Al3+离子的溶液说明溶液呈酸性,酸性条件下,NO3-和S2-发生氧化还原反应而不能共存,故C错误;
D.这几种离子之间不反应,所以能共存,故D正确;
故选D.
点评:本题考查了离子共存,明确离子共存的条件是解本题关键,注意挖掘隐含选项,易错选项是A,注意该选项的隐含选项是溶液中含有铁离子,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某铁的氧化物样品,用50mL2mol/L的盐酸恰好完全溶解,若所得溶液吸收标准状况下Cl2224ml,可以使溶液中的亚铁离子全部转化为三价铁离子.则该样品可能的化学式是( )
| A、FeO |
| B、Fe3O4 |
| C、Fe4O5 |
| D、Fe5O7 |
下列事实不能用电化学理论理解的是( )
| A、铝片不用特殊方法保存 |
| B、纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 |
| C、轮船水线以下的船壳上装一定数量的锌块 |
| D、镀锌的铁比镀锡的铁耐用 |
设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
| A、常温常压下,1 mol氦气含有的核外电子数为4 nA |
| B、一定条件下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数约为0.3 nA |
| C、标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为nA |
| D、0.1 mol/L的BaCl2溶液中Cl-数为0.2nA |
下列表示物质结构的化学用语或模型正确的是( )
A、TNT的结构简式为: |
B、苯乙醛的结构简式为: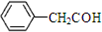 |
C、丙烷分子的球棍模型为: |
| D、乙烯的结构简式为:CH2CH2 |
下列反应的离子方程式不正确的是( )
| A、向NH4HCO3溶液中加入过量烧碱溶液:NH4++OH-═NH3↑+H2O | ||||
| B、将CO2通入到纯碱饱和溶液中:2Na++CO32-+CO2+H2O═2NaHCO3↓ | ||||
| C、向Ba(OH)2溶液中加入足量的KHSO4溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | ||||
D、将饱和FeCl3溶液滴入沸水中制胶体:Fe3++3H2O
|

