题目内容
17.已知A、B、C、D为短周期元素,简单离子A+、B2+、C-、D2-具有相同的电子结构,下列关系正确的是( )| A. | 质子数A>B>C>D | B. | 原子半径D>C>A>B | ||
| C. | 氢化物的稳定性H2D>HC | D. | 碱性的强弱AOH>B(OH)2 |
分析 短周期元素的离子A+、B2+、C-、D2-具有相同电子层结构,核外电子数相等,C、D为非金属,应处于第二周期,故D为O元素,C为F元素,A、B为金属应处于第三周期,A为Na元素,B为Mg元素,结合原子的构成和元素周期律解答.
解答 解:短周期元素的离子A+、B2+、C-、D2-具有相同电子层结构,核外电子数相等,C、D为非金属,应处于第二周期,故D为O元素,C为F元素,A、B为金属应处于第三周期,A为Na元素,B为Mg元素,.
A.质子数:Mg>Na>F>O,即质子数B>A>C>D,故A错误;
B.电子层越多,原子半径越大,电子层相同,质子数越多,原子半径越小,所以原子半径Na>Mg>O>F,故B错误;
C.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为H2O<HF,故C错误;
D.W为Mg元素,X为Na元素,金属性越强,其最高价氧化物的水化物的碱性越强,故碱性的强弱:NaOH>Mg(OH)2,故D正确.
故选D.
点评 本题考查结构与位置关系、元素周期律等,难度中等,可以根据电子层结构确定在周期表中的位置关系确定具体的元素,从而推断其性质.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
8.苹果酸的结构简式为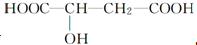 ,下列说法正确的是( )
,下列说法正确的是( )
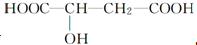 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸中能发生酯化反应的官能团有2种 | |
| B. | 1 mol苹果酸可与3 mol NaOH发生中和反应 | |
| C. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| D. | HOOC-CH2-CH(OH)-COOH与苹果酸互为同分异构体 |
5.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 标准状况下,1 L苯所含有的分子数为$\frac{{N}_{A}}{22.4}$ | |
| B. | 1 mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,22.4 LC2H4的质量为28克 | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
12.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.2 mol•L-1 FeCl3溶液中含有Cl-总数为0.6NA | |
| B. | 常温常压下,a mo1 O2与2a mo1 NO混合,降温得到混合气体中氧原子数小于4a NA | |
| C. | 2 mol NaHSO4晶体中含有阳离子的数目为4NA | |
| D. | 3g金刚石和4g石墨中的碳碳单键数目均为0.5NA |
2.下列结论是从某同学的作业本上摘录的,其中你认为肯定正确的是( )
①微粒半径:S2->Cl->S>Cl
②氢化物稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>Br>I.
①微粒半径:S2->Cl->S>Cl
②氢化物稳定性:HF>HCl>H2S>H2Se
③还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4
⑥得电子能力:F>Cl>Br>I.
| A. | ①⑤ | B. | ①③④ | C. | ②④⑥ | D. | ⑥ |
9.下列各组中的反应,属于同一反应类型的是( )
| A. | 由甲烷制一氯甲烷;由乙烯与氯化氢反应制一氯乙烷 | |
| B. | 由苯与浓硝酸和浓硫酸的混酸反应制硝基苯;由苯与液溴反应制溴苯 | |
| C. | 由乙醇制乙醛;由乙醇和乙酸反应制乙酸乙酯 | |
| D. | 由苯与氢气反应制环己烷;由淀粉水解制葡萄糖 |