题目内容
8.用 NA表示阿伏加德罗常数的值.下列判断正确的是( )| A. | 密闭容器中,2mol SO2和1mol O2充分反应,生成SO3的分子数为2 NA | |
| B. | 1L1 mol•L-1 的(NH4)2SO4 溶液中含有的 NH4+数目为2NA | |
| C. | 足量的 MnO2与 100ml 12 mol•L-1的浓盐酸充分反应,转移的电子数目为 0.6 NA | |
| D. | 常温常压下,18 mL 水含有的分子数目约为 NA |
分析 A.二氧化硫与氧气反应为可逆反应;
B.氨根离子为弱碱阳离子,水溶液中部分水解;
C.稀盐酸与二氧化锰不反应;
D.18 mL 水质量为18g,依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算.
解答 解:A.二氧化硫与氧气反应为可逆反应,可逆反应不能进行到底,所以2mol SO2和1mol O2充分反应,生成SO3的分子数小于2 NA,故A错误;
B.氨根离子为弱碱阳离子,水溶液中部分水解,所以1L1 mol•L-1 的(NH4)2SO4 溶液中含有的 NH4+数目小于2NA,故B错误;
C.足量的 MnO2与 100ml 12 mol•L-1的浓盐酸充分反应,随着反应进行盐酸浓度降低变为稀盐酸,稀盐酸不二氧化锰不反应,所以转移的电子数目小于 0.6 NA,故C错误;
D.常温常压下,18 mL 水质量为18g,物质的量为$\frac{18g}{18g/mol}$=1mol含有的分子数目约为 NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,明确盐类水解的性质、可逆反应特点、二氧化锰与浓盐酸反应条件,题目难度中等.

练习册系列答案
相关题目
18.已知HI在催化剂作用下分解速率会加快,其能量随反应进程的变化如图所示.下列说法正确的是( )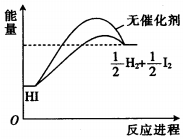

| A. | 加入催化剂,减小了反应的活化能 | |
| B. | 加入催化剂,可提高HI的平衡转化率 | |
| C. | 降低温度,HI的分解速率加快 | |
| D. | 反应物的总能量大于生成物的总能量 |
19.实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.10mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如表.
①滴定达到终点的现象是最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色,且半分钟内不褪色.此时锥形瓶内溶液的pH为8.2~10.
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字)
③排去碱式滴定管中气泡的方法应采用操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有D、F.(多选扣分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
(1)配制100mL 0.10mol/L NaOH标准溶液.
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如表.
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为0.11mol/L(保留两位有效数字)
③排去碱式滴定管中气泡的方法应采用操作丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液.

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有D、F.(多选扣分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失.
16.下列有关物质用途的说法错误的是( )
| A. | 氢氧化铁胶体可用于净水 | B. | Fe2O3可用作红色涂料 | ||
| C. | 纯碱溶液可用于去除油污 | D. | MnO2和浓HCl可用于工业制氯气 |
13.下列有关离子方程式书写正确的是电解( )
| A. | 硫化钠溶液加入稀硝酸:S2-+2H+═H2 S↑ | |
| B. | 用惰性电极电解饱和硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | NaHSO4溶液与Ba(OH)2溶液混合:HSO4-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
20.设NA为阿伏加徳罗常数的值,下列说法不正确的是( )
| A. | 56g铁片与足量浓H2SO4在加热的条件下可生成1.5NA个SO2分子 | |
| B. | 标准状况下20g D2O分子中所含中子数为10NA | |
| C. | 常温下,将0.1NA个氯化氢分子溶于1L水中,得到0.1mol/L的盐酸 | |
| D. | 2.8g乙烯和2.8g聚乙烯中含碳原子数均为0.2NA |
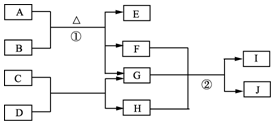 有关物质的转化关系如图1所示.A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液.请回答下列问题:
有关物质的转化关系如图1所示.A是黑色非金属单质,C、E、F均为氧化物,E、F常温下呈气态,且E能使品红褪色,G是一种常见的无色液体,I是一种难溶于水的白色胶状沉淀,能溶于B溶液.请回答下列问题: .
. ;
;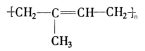 其单体的结构简式CH2=C(CH3)CH=CH2;
其单体的结构简式CH2=C(CH3)CH=CH2;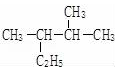 的名称(系统命名法)2,3-二甲基戊烷.
的名称(系统命名法)2,3-二甲基戊烷.