题目内容
3.为检查某石灰石样品中碳酸钙的纯度,取该样品12g放入烧杯中,再向烧杯中加入35g稀盐酸,恰好完全反应(杂质不参加反应),反应后烧杯中剩余物质共42.6g,(1)反应生成CO2的质量为4.4g;
(2)石灰石样品中碳酸钙的质量分数.
分析 (1)碳酸钙与盐酸反应是二氧化碳,烧杯内减少的质量为生成的二氧化碳的质量;
(2)根据碳原子守恒计算碳酸钙物质的量,进而计算碳酸钙质量分数.
解答 解:(1)碳酸钙与盐酸反应是二氧化碳,烧杯内减少的质量为生成的二氧化碳的质量,则反应生成CO2的质量为12g+35g-42.6g=4.4g,故答案为:4.4;
(2)二氧化碳物质的量为$\frac{4.4g}{44g/mol}$=0.1mol,根据碳原子守恒:n(CaCO3)=n(CO2)=0.1mol,故样品中碳酸钙质量分数为$\frac{0.1mol×100g/mol}{12g}$×100%=83.3%,
答:石灰石样品中碳酸钙的质量分数为83.3%.
点评 本题考查化学方程式计算,比较基础,关键是利用质量守恒定律计算二氧化碳质量.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
6.下列说法正确的是( )
| A. | 葡萄糖可通过酒化酶水解生成酒精 | |
| B. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| C. | 向植物油中加入酸性高锰酸钾紫色溶液,振荡后,酸性高锰酸钾溶液颜色褪去 | |
| D. | 淀粉溶液与稀硫酸溶液共热,再加入新制氢氧化铜悬浊液加热,无红色沉淀,则可证明淀粉没有水解 |
3.(1)某学生进行中和热测定,取用50mL0.50mol•L-1的HCl和50mL0.55mol•L-1的Na0H溶液(密度都是1g.cm-3).实验后得到以下数据:
(中和后生成的溶液的比热容为4.18J•g-1℃-1)请替该同学计算出中和热的平均值:-52.25kJ/mol.
(2)该学生测得的数据比理论值低(填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母)AB.
A.溶液混合后未及时盖好热计杯盖 B.倾倒溶液太快,有少量溅出烧杯.
| 起始温度T1/℃ | 终止温度T2/℃ | 温度差(T2-T1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.50 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)该学生测得的数据比理论值低(填“高”或“低”).
(3)从下列分析中选出该学生产生实验误差的原因可能是(填写字母)AB.
A.溶液混合后未及时盖好热计杯盖 B.倾倒溶液太快,有少量溅出烧杯.
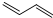 +Cl2$\stackrel{1,2-加成}{→}$
+Cl2$\stackrel{1,2-加成}{→}$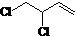 $\stackrel{1,4-加成}{→}$
$\stackrel{1,4-加成}{→}$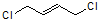
 .
.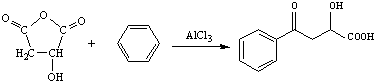 .
.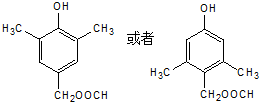 .
.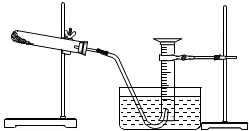 某同学完成以胆矾为原料制取氧化铜固体实验,并用氧化铜和氯酸钾的混合物制取氧气,测量生成氧气的体积.试回答:
某同学完成以胆矾为原料制取氧化铜固体实验,并用氧化铜和氯酸钾的混合物制取氧气,测量生成氧气的体积.试回答: