题目内容
9.已知A2On2-可将B2-氧化为B单质,A2On2-则被还原为A3+,又知100mL的0.3mol/L的A2On2-与150mL的0.6mol/L B2-恰好完全反应,则A2On2-中的n值为( )| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
分析 根据电子转移守恒计算A2On2-中A的化合价,再根据化合价代数和等于离子所带电荷计算n的值.
解答 解:n(A2On2-)=0.3mol/L×0.1L=0.03mol,n(B2-)=0.6mol/L×0.15L=0.09mol,
B2-氧化为B单质,A2On2-被还原为A3+,设A2On2-中A的化合价为x,则
0.03×2×(x-3)=0.09×2
解得x=+6
则(+6)×2-2n=-2,解得n=7
故选:D.
点评 本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,难度不大,注意掌握氧化还原反应中电子转移电子守恒应用.

练习册系列答案
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
20.下列物质属于离子化合物的是( )
| A. | CO2 | B. | CaO | C. | H2O2 | D. | H2SO4 |
14.下列溶液中有关物质的量浓度关系正确的是( )
| A. | pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)═c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
1.下列盛放试剂的方法,错误的是( )
| A. | 氢氟酸盛放在玻璃试剂瓶中 | |
| B. | 浓硝酸盛在棕色试剂瓶中 | |
| C. | 氢氧化钠溶液盛在带橡皮塞的玻璃瓶中 | |
| D. | 氯水盛在棕色试剂瓶中,并放置在冷暗处 |
18.在给定条件下,可以大量共存的离子组是( )
| A. | 含有0.1 mol•L-1 Fe3+的溶液中:H+、Fe2+、Na+、I- | |
| B. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| C. | 在pH=1的溶液中:Mg2+、Na+、ClO-、NO3- | |
| D. | 加入强碱再加热,既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、Cl- |
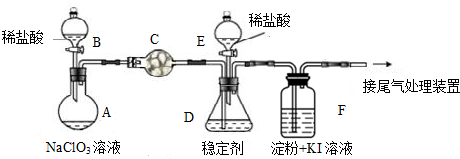
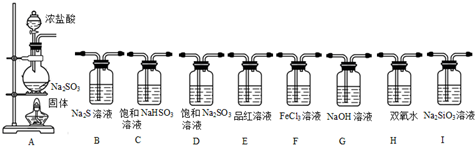
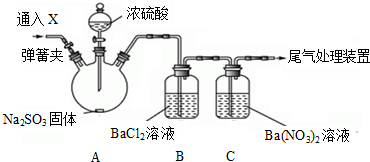

 金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得判迅猛发展.
金属镁在目前的汽车、航天、航空、机械制造、军事等产业中得判迅猛发展.