题目内容
4.非金属元素及其化合物在工农业生产中应用非常广泛.请回答以下问题:Ⅰ.氯及其化合物
ClO2与Cl2的氧化性相近.在自来水消毒和果蔬保鲜等方面应用广泛,某兴趣小组通过如下图所示,对其制备、吸收、释放和应用进行了研究.
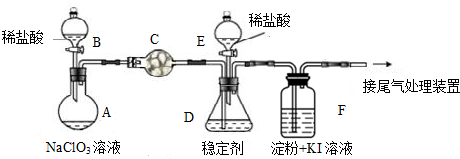
(1)A中发生反应的化学方程式:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.
(2)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是吸收氯气.
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成.
Ⅱ.硫及其化合物:
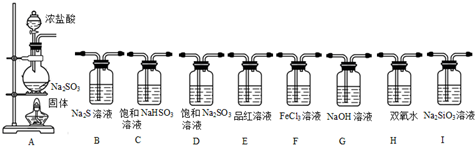
(1)选择以下装置,通过实验现象依次完成以下验证:SO2具有酸性、氧化性、还原性、漂白性.其仪器的连接顺序为ACIBFEG.
(2)利用下图装置能证明SO2不与BaCl2溶液反应,通入X气体可排除干扰达到实验目的是AD
A.CO2 B.NH3 C.O3 D.N2 E.NO2
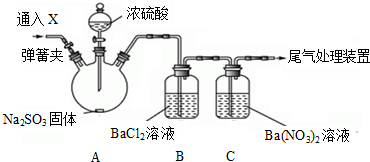
C发生的离子方程式3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+.
(3)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

按上述方案实验,当消耗标准I2溶液25.00mL时,滴定完毕,滴定终点的标志当滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色,则说明已达到终点,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为0.32g•L-1.
分析 I.A中稀盐酸和氯酸钠发生氧化还原反应生成二氧化氯,反应方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O;生成的气体中含有氯气和二氧化氯,二氧化氯在D中被稳定剂吸收生成NaClO2,则C应该吸收氯气,防止干扰实验;酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O;二氧化氯具有强氧化性,能氧化碘离子生成碘,碘遇淀粉变蓝色;
(1)稀盐酸和氯酸钠发生氧化还原反应生成二氧化氯和氯气;
(2)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,说明C能吸收氯气;
(3)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据反应物和生成物书写离子方程式;
在ClO2释放实验中,打开E的活塞,D中发生反应,二氧化氯能氧化碘离子生成碘,碘遇淀粉试液变蓝色;
II.(1)选择以下装置,通过实验现象依次完成以下验证:SO2具有酸性、氧化性、还原性、漂白性,根据实验目的及实验装置知,先用浓盐酸和亚硫酸钠制取二氧化硫,二氧化硫属于酸性氧化物,具有还原性、氧化性和漂白性,用品红溶液检验其漂白性、用硫化钠溶液检验其氧化性、用氯化铁溶液检验其还原性,二氧化硫有毒,不能直接排空,所以要用碱液处理尾气;
(2)浓硫酸和亚硫酸钠生成二氧化硫,二氧化硫通入水中生成亚硫酸,亚硫酸不稳定,易被氧化生成硫酸而产生干扰,所以要检验二氧化硫是否与氯化钡溶液反应,应该排除强氧化性物质,且也不能是碱性物质;
二氧化硫和氯化钡溶液发生氧化还原反应生成硫酸钡沉淀和NO、氢离子;
(3)滴定终点为:当滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色;
二氧化硫具有还原性、碘具有氧化性,二者在水溶液中发生反应SO2+I2+2H2O═H2SO4+2HI,根据SO2---I2计算样品中二氧化硫含量.
解答 解:I.A中稀盐酸和氯酸钠发生氧化还原反应生成二氧化氯,反应方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O;生成的气体中含有氯气和二氧化氯,二氧化氯在D中被稳定剂吸收生成NaClO2,则C应该吸收氯气,防止干扰实验;酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O;二氧化氯具有强氧化性,能氧化碘离子生成碘,碘遇淀粉变蓝色;
(1)稀盐酸和氯酸钠发生氧化还原反应生成二氧化氯和氯气,反应方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,故答案为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O;
(2)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则从C出来的气体不含氯气,说明C能吸收氯气,故答案为:吸收氯气;
(3)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据反应物和生成物书写离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O;
在ClO2释放实验中,打开E的活塞,D中发生反应,二氧化氯能氧化碘离子生成碘,碘遇淀粉试液变蓝色,所以F能检验是否有二氧化氯生成,
故答案为:4H++5ClO2-=Cl-+4ClO2↑+2H2O; 验证是否有ClO2 生成;
II.(1)选择以下装置,通过实验现象依次完成以下验证:SO2具有酸性、氧化性、还原性、漂白性,根据实验目的及实验装置知,先用浓盐酸和亚硫酸钠制取二氧化硫,二氧化硫属于酸性氧化物,具有还原性、氧化性和漂白性,用品红溶液检验其漂白性、用硫化钠溶液检验其氧化性、用氯化铁溶液检验其还原性,二氧化硫有毒,不能直接排空,所以要用碱液处理尾气,所以其装置顺序是A C I B F E G,
故答案为:A C I B F E G;
(2)浓硫酸和亚硫酸钠生成二氧化硫,二氧化硫通入水中生成亚硫酸,亚硫酸不稳定,易被氧化生成硫酸而产生干扰,所以要检验二氧化硫是否与氯化钡溶液反应,应该排除强氧化性物质且也不能是碱性物质,
臭氧和二氧化氮具有氧化性、氨气属于碱性气体,故选AD;
二氧化硫和硝酸钡溶液发生氧化还原反应生成硫酸钡沉淀、NO和氢离子,离子方程式为3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+,
故答案为:AD;3SO2+3Ba2++2NO3-+2H2O═3BaSO4↓+2NO↑+4H+;
(3)滴定终点为:当滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色;
二氧化硫具有还原性、碘具有氧化性,二者在水溶液中发生反应SO2+I2+2H2O═H2SO4+2HI,根据SO2---I2,
设二氧化硫物质的量为xmol,
SO2---I2
1mol 1mol
xmol 0.04000mol/L×0.025L
1mol:1mol=xmol:(0.04000mol/L×0.025L)
x=0.001mol,
该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)=$\frac{0.001mol×64g/mol}{0.2L}$
=0.32g/L,
故答案为:当滴入最后一滴I2溶液时,溶液从无色恰好变为蓝色,且30秒内不褪色,则说明已达到终点; 0.32.
点评 本题考查物质制备,为高频考点,涉及实验基本操作、实验仪器的性质、滴定实验、气体制备及其性质检验等知识点,明确实验原理及实验基本操作是解本题关键,难点是II(1)中仪器选取及实验先后顺序,题目难度中等.

| A. |  乙醇 | B. |  金属钠 | C. |  天然气 | D. |  乙酸 |
| A. | 均溶于水 | B. | 受热均易分解 | ||
| C. | 均为钠盐 | D. | 均能与盐酸反应放出CO2 |
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
| A. | 它是一种白色粉末,溶解度小于Na2CO3 | |
| B. | 加热至200℃左右,可完全分解,利用这种性质,可由NaHCO3制取纯碱 | |
| C. | 与Na2CO3相同质量时,分别跟足量盐酸反应后,则NaHCO3可得到较多的二氧化碳 | |
| D. | 它是一种碳酸盐 |
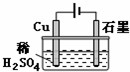
| A. | 电解过程中,铜电极上有H2产生 | |
| B. | 电解初期,主反应方程式为Cu+H2SO4$\frac{\underline{\;通电\;}}{\;}$CuSO4+H2↑ | |
| C. | 电解一定时间后,石墨电极上有铜析出 | |
| D. | 整个电解过程中,H+的浓度几乎不变 |
 框图中A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
框图中A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.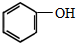 (制酚醛树脂)
(制酚醛树脂) 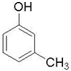 (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料) ⑥HCHO( 防腐剂 )