题目内容
工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为:
CO(g)+2H2(g)?CH3OH(g)△H
(1)如表所列数据是反应在不同温度下的化学平衡常数(K).
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 .
(2)在100℃压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的平衡常数K= (用含a、V的最简代数式表示).此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡 (填“正向”或“逆向”)移动,再次达到新平衡时,CO的浓度将 .(填“减小”或“增大”或“不变”)
(3)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化.
CO(g)+2H2(g)?CH3OH(g)△H
(1)如表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为
(2)在100℃压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的平衡常数K=
(3)判断反应达到平衡状态的依据是(填字母序号,下同)
A.生成CH3OH的速率与消耗CO的速率相等 B.混合气体的密度不变
C.混合气体的相对平均分子质量不变 D.CH3OH、CO、H2的浓度都不再发生变化.
考点:化学平衡的计算,化学平衡常数的含义,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)①根据温度升高,K减小,说明升高温度平衡向逆反应方向移动;
②根据起始量和平衡量计算转化率,根据平衡浓度计算平衡常数,以此判断温度;
(2)根据平衡常数的计算公式计算,根据平衡移动的影响判断移动方向;
(3)反应达到平衡时,正逆反应速率相等,各物质的浓度不再发生改变,由此衍生的一些物理量也不再发生变化.
②根据起始量和平衡量计算转化率,根据平衡浓度计算平衡常数,以此判断温度;
(2)根据平衡常数的计算公式计算,根据平衡移动的影响判断移动方向;
(3)反应达到平衡时,正逆反应速率相等,各物质的浓度不再发生改变,由此衍生的一些物理量也不再发生变化.
解答:
解:(1)①温度升高,K减小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,故答案为:<;
②达到平衡时测得c(CO)=0.2mol/L,则转化的CO的物质的量为2.0mol-0.2mol/L×2L=1.6mol,
所以CO的转化率为
×100%=80%,则
CO(g)+2H2(g)?CH3OH(g)
起始:1mol/L 3mol/L 0
转化:0.8mol/L 1.6mol/L 0.8mol/L
平衡:0.2mol/L 1.4mol/L 0.8mol/L
所以:k=
=2.041(mol/L)-2,温度应为250℃,
故答案为:80%;250℃;
(2)
CO(g)+2H2(g)?CH3OH(g)
起始(mol/L):
O
转化(mol/L):0.5×
0.5×
平衡(mol/L):0.5×
0.5×
k=
=
,
再向容器中充入a mol CH3OH(g),生成物浓度增大,平衡向逆反应方向移动,再次达到新平衡时,虽然CO的物质的量增多,但比总物质的量的增多要小,CO的体积分数反而减小,
故答案为:
;逆向;减小;
(3)A.无论是否达到平衡状态,生成CH3OH的速率与消耗CO的速率相等,故A错误;
B.无论是否达到平衡状态,气体的质量不变,容器的体积不变,则混合气体的密度不变,故B错误;
C.反应前后物质的量变化,质量守恒,混合气体的相对平均分子质量不变,说明反应达到平衡状态,故C正确;
D.CH3OH、CO、H2的浓度都不再发生变化,说明反应达到平衡状态,故D正确.
故答案为:CD.
②达到平衡时测得c(CO)=0.2mol/L,则转化的CO的物质的量为2.0mol-0.2mol/L×2L=1.6mol,
所以CO的转化率为
| 1.6mol |
| 2.0mol |
CO(g)+2H2(g)?CH3OH(g)
起始:1mol/L 3mol/L 0
转化:0.8mol/L 1.6mol/L 0.8mol/L
平衡:0.2mol/L 1.4mol/L 0.8mol/L
所以:k=
| 0.8mol/L |
| 0.2mol/L×(1.4mol/L)2 |
故答案为:80%;250℃;
(2)
CO(g)+2H2(g)?CH3OH(g)
起始(mol/L):
| a |
| V |
| 2a |
| V |
转化(mol/L):0.5×
| a |
| V |
| a |
| V |
| a |
| V |
平衡(mol/L):0.5×
| a |
| V |
| a |
| V |
| a |
| V |
k=
0.5×
| ||||
0.5×
|
| V2 |
| a2 |
再向容器中充入a mol CH3OH(g),生成物浓度增大,平衡向逆反应方向移动,再次达到新平衡时,虽然CO的物质的量增多,但比总物质的量的增多要小,CO的体积分数反而减小,
故答案为:
| V2 |
| a2 |
(3)A.无论是否达到平衡状态,生成CH3OH的速率与消耗CO的速率相等,故A错误;
B.无论是否达到平衡状态,气体的质量不变,容器的体积不变,则混合气体的密度不变,故B错误;
C.反应前后物质的量变化,质量守恒,混合气体的相对平均分子质量不变,说明反应达到平衡状态,故C正确;
D.CH3OH、CO、H2的浓度都不再发生变化,说明反应达到平衡状态,故D正确.
故答案为:CD.
点评:本题考查较为综合,涉及化学平衡的计算,平衡状态的判断,平衡常数的计算与运用以及等效平衡问题,题目难度较大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
1.8mol氯气与足量的元素A的单质完全反应生成1.2mol的氯化物AClx,则x的值为( )
| A、1 | B、2 | C、3 | D、4 |
常温下,将pH=3的盐酸和10-3mol?L-1的氨水等体积混和后,溶液中离子浓度关系正确的是( )
| A、[NH4+]>[Cl-]>[H+]>[OH-] |
| B、[NH4+]>[Cl-]>[OH-]>[H+] |
| C、[Cl-]>[NH4+]>[H+]>[OH-] |
| D、[Cl-]>[NH4+]>[OH-]>[H+] |
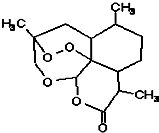 中国国家主席胡锦涛在中非合作论坛北京峰会上承诺:“提供3亿元人民币无偿援款帮助非洲防治疟疾,用于提供青蒿素药品及设立30个抗疟中心”.中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )
中国国家主席胡锦涛在中非合作论坛北京峰会上承诺:“提供3亿元人民币无偿援款帮助非洲防治疟疾,用于提供青蒿素药品及设立30个抗疟中心”.中国研制成功的全球唯一的治疗疟疾特效药--青蒿素,是数亿外国人眼中的“中国神药”,结构如图所示.目前售价每克225美元,世界年产量15吨,是需求量的十分之一,供不应求.下列关于青蒿素的说法正确的是( )| A、是一种烃 |
| B、属于高分子化合物 |
| C、属于芳香族化合物 |
| D、分子式是C15H22O5 |
中科大教授钱逸泰等以CCl4和金属钠为原料,在700°C时反应制造出纳米级金刚石粉末和另一种化合物.同学们对此有下列一些“理解”,你认为其中错误的是( )
| A、金刚石属于金属单质 |
| B、制造过程中元素种类没有改变 |
| C、CCl4是一种化合物 |
| D、这个反应是置换反应 |
 (1)相对分子质量为72的某烃,其一氯代物只有一种,则该烃的一氯代物的结构简式为
(1)相对分子质量为72的某烃,其一氯代物只有一种,则该烃的一氯代物的结构简式为