题目内容
1.8mol氯气与足量的元素A的单质完全反应生成1.2mol的氯化物AClx,则x的值为( )
| A、1 | B、2 | C、3 | D、4 |
考点:化学方程式的有关计算
专题:计算题
分析:根据氯原子守恒列方程计算x的值.
解答:
解:1.8mol氯气与足量的元素A的单质完全反应生成1.2mol的氯化物AClx,
根据Cl原子守恒有:1.8mol×2=1.2mol×x,解得x=3,
故选C.
根据Cl原子守恒有:1.8mol×2=1.2mol×x,解得x=3,
故选C.
点评:本题考查化学方程式的计算,注意根据原子守恒计算,比较基础.

练习册系列答案
相关题目
绿色化学的目标是( )
| A、减少对环境的污染 |
| B、防患于未然,最终杜绝化学污染源 |
| C、设计对人类健康和环境更安全的化合物 |
| D、研究变换基本原料和起始化合物 |
下列说法正确的是( )
| A、SO2和CO2是造成“酸雨”的罪魁祸首 |
| B、“水华”是由于水中富含氯元素造成的 |
| C、“光化学烟雾”与NO2的排放有关 |
| D、燃烧树叶和氢气都不会造成大气污染 |
下列实验操作中正确的是( )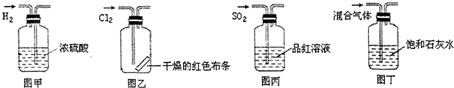

| A、图甲所示,可得到干燥的氢气 |
| B、图乙所示,可以验证氯气的漂白性 |
| C、图丙所示,可以验证SO2的漂白性 |
| D、图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2 |
下列离子方程式的书写正确是( )
| A、实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B、铁和稀盐酸反应:Fe+2H+=H2↑+Fe2+ |
| C、氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓ |
| D、钠投入水中:Na+H2O=Na++OH-+H2↑ |
 电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液c;A、B分别是两块电极板,通过导线与直流电源相连.