题目内容
如表是元素周期表的短周期部分,表中字母分别表示一种元素.
请回答下列问题:
(1)g与b可形成离子化合物b2g,试写出它的电子式 .
(2)e、f、g 三种元素气态氢化物的稳定性由弱到强的顺序为(用化学式表示) .
(3)从化合物c2g3与eg2组成的混合物中分离提纯eg2,可加入上述 (用元素符号表示)两种元素形成化合物的水溶液后再过滤洗涤.
(4)在1L的密闭容器中,通入1mol f2气体和3mol a2气体,一定温度下反应生成fa3气体,2min时,测得f2的浓度为0.75mol?L-1,则2min时fa3的物质的量为 mol,a2的平均反应速率v(a2)= mol?(L?min)-1.
(5)a、d两种元素可形成多种化合物,其中化合物X的产量是衡量一个国家石油化工发展水平的标志.X可与H2O在一定条件下反应生成化合物A,该反应的化学方程式为:
.
(6)航天技术中常使用a和g单质组成的燃料电池,该电池具有高能、轻便和不污染环境等优点.该电池反应式为 .
| a | |||||||
| d | f | g | |||||
| b | c | e | h | ||||
(1)g与b可形成离子化合物b2g,试写出它的电子式
(2)e、f、g 三种元素气态氢化物的稳定性由弱到强的顺序为(用化学式表示)
(3)从化合物c2g3与eg2组成的混合物中分离提纯eg2,可加入上述
(4)在1L的密闭容器中,通入1mol f2气体和3mol a2气体,一定温度下反应生成fa3气体,2min时,测得f2的浓度为0.75mol?L-1,则2min时fa3的物质的量为
(5)a、d两种元素可形成多种化合物,其中化合物X的产量是衡量一个国家石油化工发展水平的标志.X可与H2O在一定条件下反应生成化合物A,该反应的化学方程式为:
(6)航天技术中常使用a和g单质组成的燃料电池,该电池具有高能、轻便和不污染环境等优点.该电池反应式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由短周期元素在周期表中的位置可知,a为H、b为Na、c为Al、d为C、e为Si、f为N、g为O、h为Cl,
(1)g与b可形成离子化合物b2g为Na2O,属于离子化合物,由钠离子与氧离子构成;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
(3)氧化铝溶于盐酸,而二氧化硅不能溶于盐酸,故从化合物Al2O3与SiO2组成的混合物中分离提纯SiO2,可以先加入盐酸,再过滤洗涤;
(4)计算氮气的浓度变化量,再计算氨气的浓度变化量,根据n=cV计算生成氨气;计算氢气的浓度变化量,根据速率公式计算v(氢气);
(5)H、C两元素组成的化合物X的产量是衡量一个国家石油化工发展水平的标志,则X为乙烯,可与H2O在一定条件下发生加成反应生成乙醇;
(6)氢气、氧气构成的燃料电池,本质是氢气燃烧生成水.
(1)g与b可形成离子化合物b2g为Na2O,属于离子化合物,由钠离子与氧离子构成;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定;
(3)氧化铝溶于盐酸,而二氧化硅不能溶于盐酸,故从化合物Al2O3与SiO2组成的混合物中分离提纯SiO2,可以先加入盐酸,再过滤洗涤;
(4)计算氮气的浓度变化量,再计算氨气的浓度变化量,根据n=cV计算生成氨气;计算氢气的浓度变化量,根据速率公式计算v(氢气);
(5)H、C两元素组成的化合物X的产量是衡量一个国家石油化工发展水平的标志,则X为乙烯,可与H2O在一定条件下发生加成反应生成乙醇;
(6)氢气、氧气构成的燃料电池,本质是氢气燃烧生成水.
解答:
解:由短周期元素在周期表中的位置可知,a为H、b为Na、c为Al、d为C、e为Si、f为N、g为O、h为Cl,
(1)g与b可形成离子化合物b2g为Na2O,属于离子化合物,由钠离子与氧离子构成,电子式为: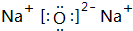 ,
,
故答案为: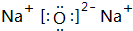 ;
;
(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性O>N>Si,非金属性越强,氢化物越稳定,故氢化物稳定性SiH4<NH3<H2O,
故答案为:SiH4<NH3<H2O;
(3)氧化铝溶于盐酸,而二氧化硅不能溶于盐酸,故从化合物Al2O3与SiO2组成的混合物中分离提纯SiO2,可以先加入盐酸,再过滤洗涤,
故答案为:H、Cl;
(4)2min时,测得N2的浓度为0.75mol?L-1,则△c(N2)=
-0.75mol/L=0.25mol/L,故△c(NH3)=2△c(N2)=0.5mol/L,则2min时NH3的物质的量=0.5mol/L×1L=0.5mol,
△c(H2)=3△c(N2)=0.75mol/L,故v(H2)=
=0.375mol/(L.min),
故答案为:0.5;0.375;
2△c(N2)=0.5mol/L,则2min时NH3的物质的量=0.5mol/L×1L=0.5mol,
(5)H、C两元素组成的化合物X的产量是衡量一个国家石油化工发展水平的标志,则X为乙烯,可与H2O在一定条件下发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O
CH3CH2OH,
故答案为:CH2=CH2+H2O
CH3CH2OH;
(6)氢气、氧气构成的燃料电池,本质是氢气燃烧生成水,电池总反应式为:2H2+O2=2H2O,
故答案为:2H2+O2=2H2O.
(1)g与b可形成离子化合物b2g为Na2O,属于离子化合物,由钠离子与氧离子构成,电子式为:
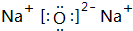 ,
,故答案为:
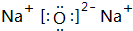 ;
;(2)同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故非金属性O>N>Si,非金属性越强,氢化物越稳定,故氢化物稳定性SiH4<NH3<H2O,
故答案为:SiH4<NH3<H2O;
(3)氧化铝溶于盐酸,而二氧化硅不能溶于盐酸,故从化合物Al2O3与SiO2组成的混合物中分离提纯SiO2,可以先加入盐酸,再过滤洗涤,
故答案为:H、Cl;
(4)2min时,测得N2的浓度为0.75mol?L-1,则△c(N2)=
| 1mol |
| 1L |
△c(H2)=3△c(N2)=0.75mol/L,故v(H2)=
| 0.75mol/L |
| 2min |
故答案为:0.5;0.375;
2△c(N2)=0.5mol/L,则2min时NH3的物质的量=0.5mol/L×1L=0.5mol,
(5)H、C两元素组成的化合物X的产量是衡量一个国家石油化工发展水平的标志,则X为乙烯,可与H2O在一定条件下发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O
| 催化剂 |
故答案为:CH2=CH2+H2O
| 催化剂 |
(6)氢气、氧气构成的燃料电池,本质是氢气燃烧生成水,电池总反应式为:2H2+O2=2H2O,
故答案为:2H2+O2=2H2O.
点评:本题考查元素周期表与元素周期律的综合应用,题目比较综合,涉及电子式、化学反应速率计算、乙烯性质、原电池等,难度不大,侧重对基础知识的巩固.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
短周期元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列推断正确的是( )
| A、原子半径:W>X>Z>Y |
| B、热稳定性:H2Y>HZ |
| C、离子半径:W2+>Y2- |
| D、碱性:XOH>W(OH)2 |
下列反应属于放热反应的是( )
| A、氢气还原氧化铜 |
| B、氢气在氧气中燃烧 |
| C、碳酸钙高温分解成氧化钙和二氧化碳 |
| D、氢氧化钾和氯化铵的反应 |