题目内容
1.下列反应的离子方程式不正确的是( )| A. | 在NaOH溶液中滴入几滴NH4Cl溶液:NH4++OH-═NH3↑+H2O | |
| B. | 氟气通入水中:2F2+2H2O═4H++4F-+O2 | |
| C. | AlCl3溶液中通入过量的氨气:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| D. | 将少量铜屑放入浓硝酸中:Cu+4 H++2NO3-═Cu2++2 NO2↑+2 H2O |
分析 A.在NaOH溶液中滴入几滴NH4Cl溶液反应生成氯化钠和氨气、水;
B.HF为弱酸,应保留化学式;
C.AlCl3溶液中通入过量的氨气,反应生成氢氧化铝沉淀和氯化铵;
D.铜与浓硝酸反应生成硝酸铜和二氧化氮和水.
解答 解:A.在NaOH溶液中滴入几滴NH4Cl溶液,离子方程式:NH4++OH-═NH3↑+H2O,故A正确;
B.氟气通入水中,离子方程式:2F2+2H2O═4HF+O2,故B错误;
C.AlCl3溶液中通入过量的氨气,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C正确;
D.将少量铜屑放入浓硝酸中,离子方程式:Cu+4 H++2NO3-═Cu2++2 NO2↑+2 H2O,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,侧重考查复分解反应、氧化还原反应离子方程式的书写,明确物质的性质及反应实质是解题关键,题目难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
14. 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
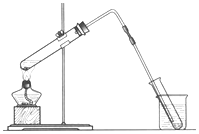
(1)如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是导气冷凝,烧杯中还应盛装的物质是冰水.
(2)海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I-的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
?海带灼烧时用来盛装海带的仪器是坩埚(填仪器名称)
?已知KMnO4、H2O2、Cl2均可与I-反应生成I2,且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl-.从绿色化学的角度将I-转化成I2,最好选择H2O2.
(3)海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
?①若只除去其中的不溶性杂质,应经过的实验步骤是过滤、洗涤、干燥.
?②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
③为确保杂质除尽,所加试剂应适当过量.如何判断SO42-是否除尽?静置一段时间后,取少量上层清液于试管中,再滴加BaCl2溶液,若无沉淀生成,说明SO42-沉淀完全,反之未沉淀完全
④上述除杂试剂加入的先后顺序应满足的一般条件是Na2CO3溶液应加在BaCl2溶液之后
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是除去过量除杂试剂中的OH-和CO32-.
 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.(1)如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是导气冷凝,烧杯中还应盛装的物质是冰水.
(2)海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I-的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
?海带灼烧时用来盛装海带的仪器是坩埚(填仪器名称)
?已知KMnO4、H2O2、Cl2均可与I-反应生成I2,且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl-.从绿色化学的角度将I-转化成I2,最好选择H2O2.
(3)海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
?①若只除去其中的不溶性杂质,应经过的实验步骤是过滤、洗涤、干燥.
?②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
| 杂质 | CaCl2 | MgCl2 | Na2SO4 |
| 除杂试剂 | Na2CO3 | NaOH | BaCl2 |
④上述除杂试剂加入的先后顺序应满足的一般条件是Na2CO3溶液应加在BaCl2溶液之后
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是除去过量除杂试剂中的OH-和CO32-.
12.向实验室做完铝热反应(Al和氧化铁)后的混合物中,加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的离子组正确的是( )
| A. | 通入过量Cl2:Cl-、Fe2+、SO42-、Al3+ | |
| B. | 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH- | |
| C. | 加入过量氨水:Na+、NH4+、SO42-、AlO2- | |
| D. | 加入过量铜粉:NO3-、Fe3+、SO42-、Al3+ |
9.Cl2溶于水发生反应:Cl2+H2O?HCl+HClO,在该反应的平衡体系中通入少量H37Cl,则一段时间后37Cl可能存在于( )
| A. | 仅HCl | B. | 只有HCl和HClO | C. | 只有HCl和Cl2 | D. | HCl、HClO和Cl2 |
16.下列关于粒子结构的描述不正确的是( )
| A. | H2S和NH3均是价电子总数为8的极性分子 | |
| B. | HS-和HCl均是含一个极性键的18电子粒子 | |
| C. | CH2Cl2和CCl4均是四面体构型的非极性分子 | |
| D. | SO2和SO3来化轨道类型均为sp2杂化,空间构型分别为V形、平面三角形 |
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g) △H>0一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s[K] | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L