题目内容
5.下列物质的性质比较,正确的是( )| A. | 原子半径:O>N>C | B. | 碱性:LiOH>NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
分析 A、同周期从左到右原子半径依次减小;
B、金属性越强,则对应的最高价氧化物的水化物的碱性越强;
C、同一周期,原子序数越大,非金属性越强,同一主族,原子序数越小,非金属性越强;
D、非金属性越强,气态氢化物越稳定.
解答 解:A、同周期从左到右原子半径依次减小,所以原子半径大小为C>N>O,故A错误;
B、同主族从上到下金属性依次增强,则金属性K>Na>Li,则对应的最高价氧化物的水化物的碱性为KOH>NaOH>LiOH,故B错误;
C、由于原子序数Cl>S>P,故非金属性Cl>S>P,故C错误;
D、同主族从上到下非金属性依次减弱,则非金属性F>Cl>S,所以气态氢化物的稳定性为HF>HCl>H2S,故D正确;故选D.
点评 本题考查非金属性和金属性的比较及元素周期律,熟悉非金属元素和金属元素的性质变化规律,及非金属性的比较方法即可解答,难度不大.

练习册系列答案
相关题目
15.已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
| A. | Fe3O4+4CO=3Fe+4CO2△H=-14kJ•mol-1 | |
| B. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-22kJ•mol-1 | |
| C. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=+14kJ•mol-1 | |
| D. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-14kJ•mol-1 |
16.下列说法中,与盐的水解无关的正确说法是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
| A. | ①④⑥ | B. | ②③⑤ | C. | ③④⑤ | D. | 全有关 |
13.最容易形成阳离子的元素是( )
| A. | K | B. | Na | C. | F | D. | Cl |
20.下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
| A. | A原子最外层外层电子数比B原子最外层外层电子数少 | |
| B. | A原子电子层数比B原子电子层数多 | |
| C. | 常温时,A能从酸中置换出氢,而B不能 | |
| D. | 1molA从酸中置换生成的氢气比1molB从酸中置换生成的氢气多 |
17.下列离子中,电子数和质子数与Na+相同的是( )
| A. | H3O+ | B. | F- | C. | OH- | D. | Ne |
14.一定质量的CH4完全燃烧后得到的产物是CO、CO2和 H2O,此混合物的质量为49.6g,通过足量的浓硫酸时减少质量25.2g,若将此混合气体通过澄清石灰水溶液,最多可得到沉淀质量为( )
| A. | 30g | B. | 40g | C. | 70g | D. | 80g |
15.关于如图所示的原电池,下列说法不正确的是( )
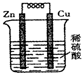

| A. | 铜片为正极,锌片为负极 | B. | 锌片溶解,质量减少 | ||
| C. | 铜片上有气泡产生 | D. | 电子由铜片经导线流向锌片 |
 在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: