题目内容
5.常温下,下列有关0.1mol•L-1的NH4Cl溶液的说法正确的是( )| A. | pH相同的盐酸与氯化铵溶液中,水的电离程度相同 | |
| B. | 溶液加水稀释时,$\frac{c(N{H}_{3}{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$逐渐增大 | |
| C. | 加入少量Mg(OH)2固体,c(NH4+)减小 | |
| D. | 加入等体积0.05mol﹒L-1NaOH溶液时:c(Na+)=c(CI-)>c(NH4+)>c(OH-)>c(H+) |
分析 A.酸抑制水的电离、能水解的盐促进水的电离;
B.水解常数只受温度影响;
C.NH4+能与Mg(OH)2电离的OH-结合生成NH3•H2O;
D.0.1mol•L-1的NH4Cl溶液中加入等体积0.05mol﹒L-1NaOH溶液,溶液中溶质为等浓度的NaCl、NH3•H2O、NH4Cl.
解答 解:A.酸抑制水的电离、能水解的盐促进水的电离,pH相同的盐酸与氯化铵溶液,氯化铵溶液中水的电离程度大于盐酸中水的电离程度,故A错误;
B.水解常数只受温度影响,溶液加水稀释时,水解常数Kh=$\frac{c(N{H}_{3}{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$不变,故B错误;
C.0.1mol•L-1的NH4Cl溶液中加入少量Mg(OH)2固体,NH4+能与Mg(OH)2电离的OH-结合生成NH3•H2O,所以c(NH4+)减小,故C正确;
D.0.1mol•L-1的NH4Cl溶液中加入等体积0.05mol﹒L-1NaOH溶液,溶液中溶质为等浓度的NaCl、NH3•H2O、NH4Cl,溶液显碱性,溶液中离子浓度关系为c(NH4+)>c(Na+)=c(CI-)>c(OH-)>c(H+),故D错误.
故选C.
点评 本题考查盐类的水解、离子浓度大小比较,题目难度中等,试题侧重于影响盐类水解的因素的考查,有利于培养学生的良好的科学素养和提高学习的积极性,解题时结合影响盐类水解的因素分析.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
16.下列说法正确的是(NA为阿伏加德罗常数的值)( )
| A. | 14g氮气含有的原子数为0.5NA | |
| B. | 4 g金属钙变成钙离子时失去的电子数为0.1NA | |
| C. | 1 mol O2分子的质量等于1 mol氧原子的质量 | |
| D. | 16 g O2分子和16g O3分子所含的氧原子数目相等 |
13.在碳酸钙中加入适量盐酸至二者恰好完全反应,得到溶液M.下列离子在溶液M中能大量共存,且所得溶液为无色的是( )
| A. | Na+、K+、Cl-、NO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、Ag+、NO3-、HCO3- | D. | Na+、NH4+、CO32-、OH- |
20.在2A+B?3C+5D反应中,表示该反应速率最快的是( )
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.8 mol•L-1•s-1 | D. | v (D)=1 mol•L-1•s-1 |
17.下列有关化学用语表示正确的是( )
| A. | H3O+的电子式: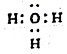 | |
| B. | 氨基的结构式:-NH2 | |
| C. | 乙烷的二氯代物有两种(不考虑立体异构) | |
| D. | NaHS显碱性的原因:HS-+H2O?S2-+H3O+ |
14.下列关于同温同压下的两种气体 12C18O和14N2的判断不正确的是( )
| A. | 体积相等时密度不相等 | B. | 原子数相等时具有的中子数不相等 | ||
| C. | 体积相等时具有的电子数相等 | D. | 质量相等时具有的质子数相等 |
15.利用下列反应不能制得括号中纯净物的是 ( )
| A. | 等物质的量氯气与乙烷在光照条件下反应(氯乙烷) | |
| B. | 乙烯与水加成(乙醇) | |
| C. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| D. | 乙烯与氢气加成(乙烷) |