题目内容
16.下列说法正确的是(NA为阿伏加德罗常数的值)( )| A. | 14g氮气含有的原子数为0.5NA | |
| B. | 4 g金属钙变成钙离子时失去的电子数为0.1NA | |
| C. | 1 mol O2分子的质量等于1 mol氧原子的质量 | |
| D. | 16 g O2分子和16g O3分子所含的氧原子数目相等 |
分析 A、求出氮气的物质的量,然后根据氮气为双原子分子来分析;
B、求出钙的物质的量,然后根据钙变为钙离子时失去2个电子来分析;
C、1mol氧气中含2mol氧原子;
D、氧气和臭氧均由氧原子构成.
解答 解:A、14g氮气的物质的量为0.5mol,而氮气为双原子分子,故0.5mol氮气中含1mol氮原子即NA个,故A错误;
B、4g钙的物质的量为0.1mol,而钙变为钙离子时失去2个电子,故0.1mol钙原子失去0.2NA个电子,故B错误;
C、1mol氧气中含2mol氧原子,故1mol氧气分子的质量与2mol氧原子的质量相同,故C错误;
D、氧气和臭氧均由氧原子构成,故16g氧气和16g臭氧中含有的氧原子的物质的量均为1mol,即氧原子均为NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
4.下列各组原子中,彼此化学性质一定相似的是( )
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子 | |
| C. | 2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子 | |
| D. | 最外层都只有一个电子的X、Y原子 |
11.下列检验溶液中的某种离子及除去杂质的操作方法正确的是( )
| A. | 向某溶液中加AgNO3溶液产生白色沉淀,证明有Cl- | |
| B. | 向某溶液中加稀HCl,无明显现象,再加入BaCl2溶液产生白色沉淀,证明有SO42- | |
| C. | 除去稀HCl中的少量H2SO4,可加入适量的Ba(NO3)2后再过滤 | |
| D. | 除去NaCl溶液中少量的Na2CO3,可加入适量的H2SO4溶液 |
1.把4mol A气体和4mol B气体混合放入2L的恒容密闭容器中,在一定条件下发生反应:2A(g)+2B(g)?C(g)+2D(g);经5min达到平衡,测得压强减小了10%,下列说法中正确的是( )
| A. | 平衡体系中C的体积分数为$\frac{1}{9}$ | B. | 平衡时A的浓度为2.4mol/L | ||
| C. | D的平均速率为0.32mol/L•min | D. | B的转化率为20% |
5.常温下,下列有关0.1mol•L-1的NH4Cl溶液的说法正确的是( )
| A. | pH相同的盐酸与氯化铵溶液中,水的电离程度相同 | |
| B. | 溶液加水稀释时,$\frac{c(N{H}_{3}{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$逐渐增大 | |
| C. | 加入少量Mg(OH)2固体,c(NH4+)减小 | |
| D. | 加入等体积0.05mol﹒L-1NaOH溶液时:c(Na+)=c(CI-)>c(NH4+)>c(OH-)>c(H+) |
6.下列互为同位素的是( )
| A. | Na和Na+ | B. | 35Cl和37Cl | ||
| C. | 14N和 14C | D. | ${\;}_{8}^{16}$O2和${\;}_{8}^{18}$O2 |
 2Z(g)在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如右图所示,下列判断正确的是( )
2Z(g)在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如右图所示,下列判断正确的是( )
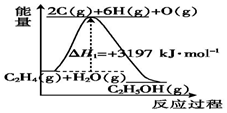 乙醇用途广泛,常用作溶剂、饮料、燃料等.
乙醇用途广泛,常用作溶剂、饮料、燃料等.