题目内容
17.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 18 g D2O和18 g H2O中含有的质子数均为10NA | |
| B. | 1 mol Cu和2mol热的浓硫酸反应可生成NA个SO2分子 | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| D. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 |
分析 A、重水的摩尔质量为20g/mol;
B、铜只能与浓硫酸反应;
C、铁变为四氧化三铁时,变为+$\frac{8}{3}$价;
D、求出混合物的物质的量,然后根据氮气和氢气均为双原子分子来分析.
解答 解:A、重水的摩尔质量为20g/mol,且两者中均含10个质子,故18 g D2O和18 g H2O的物质的量不相等,所以质子数不相等,故A错误;
B、浓硫酸反应时浓度变稀,和铜的反应即停止,故生成的SO2少于NA个,故B错误;
C、铁变为四氧化三铁时,变为+$\frac{8}{3}$价,故3mol铁失去8mol电子即8NA个,故C正确;
D、标准状况下22.4 L N2和H2混合气为1 mol,而由于氮气和氢气均是双原子分子,故1mol混合气体中含有2 NA个原子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
8.下列叙述正确的是( )
| A. | 随着化学科学的发展和提高,自然界的一切都将以人的意志为转移 | |
| B. | 生物固氮是指植物通过叶面直接吸收空气的氮气 | |
| C. | 光导纤维是以二氧化硅为主要原料制成的 | |
| D. | 绿色食品是不含任何化学物质的食品 |
5.能正确表示下列反应的离子方程式的是( )
| A. | 将铜屑加入Fe3+溶液中:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 碳酸钠水解:CO32-+H2O═HCO3-+OH- | |
| C. | 食醋滴到鸡蛋壳上:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 将铜粉加入稀硫酸中:Cu+2H+═Cu2++H2↑ |
12.某物质具有较低的熔点和沸点,且又难溶于水,这种物质可能是( )
| A. | 原子晶体 | B. | 非极性分子型物质 | ||
| C. | 极性分子型物质 | D. | 离子晶体 |
2.在2KMnO4+16HCl=2MnCl2+5Cl2↑+8H2O+2KCl的反应中,氧化剂和还原剂物质的量之比是( )
| A. | 1:8 | B. | 8:1 | C. | 1:5 | D. | 5:1 |
20.在一定条件下的密闭容器中,加入 2molSO2和 1molO2,充分反应后能证明2SO2+O2$?_{△}^{催化剂}$ 2SO3是可逆反应的事实是( )
| A. | O2仍然为 1mol | B. | 反应足够长时间后,速率变为零 | ||
| C. | SO2、O2和 SO3 同时存在 | D. | SO2完全转化为 SO3 |
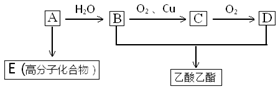 已知:
已知: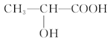 乳酸兼有乙酸和乙醇所具有的化学性质现以A为原料合成乙酸乙酯及高分子化合物E,其合成路线如图所示:
乳酸兼有乙酸和乙醇所具有的化学性质现以A为原料合成乙酸乙酯及高分子化合物E,其合成路线如图所示: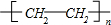 .
. .
.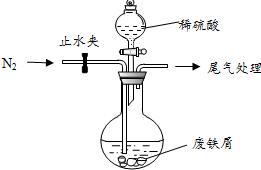 绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究: .
.