题目内容
17.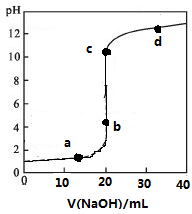 常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )| A. | 可选酚酞或甲基橙作指示剂 | |
| B. | 滴定前HR溶液中存在大量HR分子 | |
| C. | V=20 mL时,溶液中水电离的:c(H+)×c(OH-)=1×10-14mol2/L2 | |
| D. | c点时溶液中离子浓度大小关系有c(Na+)>c(R-)>c(OH-)>c(H+) |
分析 图象分析可知氢氧化钠溶液加入20ml反应生成NaR溶液,溶液PH大于7显碱性,为R-水解导致,HR为弱酸,主要以分子形成存在,当加入氢氧化钠20mL,时,两者恰好反应生成NaR,由于温度不变,水的离子积常数不变,c点达到滴定终点,溶质为NaR,R-水解呈碱性,据此分析溶液中存在粒子浓度大小关系.
解答 解:图象分析可知氢氧化钠溶液加入20ml反应生成NaR溶液,溶液PH大于7显碱性,为R-水解导致,HR为弱酸,
A、c点达到滴定终点,溶质为NaR,R-水解呈碱性,选择指示剂变色范围较近的酚酞,不用甲基橙四因为变色范围大,导致误差大,故A错误;
B、HR为弱酸,滴定前主要以分子形成存在,故B正确;
C、V=20 mL时,由于温度不变,水的离子积常数不变,c(H+)×c(OH-)=1×10-14mol2/L2,故C正确;
D、c点达到滴定终点,溶质为NaR,R-水解呈碱性,c(Na+)>c(R-)>c(OH-)>c(H+),故D正确;
故选A.
点评 本题考查酸碱混合溶液定性判断,为高考常见题型,题目难度中等,试题侧重于学生的分析能力的考查,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
17.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( )
| A. | Zn为电池的负极 | |
| B. | 正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O | |
| C. | 该电池放电过程中电解质溶液浓度不变 | |
| D. | 电池工作时OH-向负极迁移 |
5.雾霾是雾和霾的混合物,在空气中能形成溶胶,PM2.5是“罪魁”.下列有关说法不正确的是( )
| A. | 雾霾的形成与化石燃料的燃烧有关 | |
| B. | 海南不存在雾霾天气,无需防治PM2.5的污染 | |
| C. | 在雾霾天气中行车,打开车灯可观察到丁达尔效应 | |
| D. | 调整工业能源结构,推广清洁能源的使用,能有效地减少PM2.5的污染 |
12.物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题:
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2和sp,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:

解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}a}{4}$pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3.
(1)第二周期中,元素的第一电离能处于B与N之间的元素有3种.
(2)某元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为3d84s2.
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型是sp2和sp,1mol(C2H5O)3P=O分子中含有的σ键的数目为25NA.
(4)已知固态NH3、H2O、HF的氢键键能和结构如图1:
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

解释H2O、HF、NH3沸点依次降低的原因单个氢键的键能是(HF)n>冰>(NH3)n,而平均每个分子含氢键数:冰中2个,(HF)n和(NH3)n只有1个,气化要克服的氢键的总键能是冰>(HF)n>(NH3)n.
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.碳化硅晶胞结构中每个碳原子周围与其距离最近的硅原子有4个,与碳原子等距离最近的碳原子有12个.已知碳化硅晶胞边长为apm,则晶胞图2中1号硅原子和2号碳原子之间的距离为$\frac{\sqrt{11}a}{4}$pm,碳化硅的密度为$\frac{1.6×1{0}^{32}}{{a}^{3}×{N}_{A}}$g/cm3.
2.某实验室小组偶然发现将镁条插入饱和NaHCO3溶液中,镁条表面出现大量气泡.为了探究产生此现象的原因,该小组设计实验探究如下:
(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程在烧杯中加入足量碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可.饱和NaHCO3溶液pH=8.4,用离子方程式表示HCO3-+H2O?H2CO3+OH-.
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同.表中不要留空格):
(3)对于反应②中产生的气体(不考虑水蒸气),请你完成假设二和假设三:
假设一:只有CO2;假设二:只有H2;假设三:H2和CO2
为检验其中是否含有CO2,写出实验步骤和结论.
(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程在烧杯中加入足量碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可.饱和NaHCO3溶液pH=8.4,用离子方程式表示HCO3-+H2O?H2CO3+OH-.
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同.表中不要留空格):
序号 | 实验操作 | 实验现象 | 实验结论 |
| 1 | 将镁条投入5ml蒸馏水 | 微量气泡 | |
| 2 | 将镁条投入5ml饱和NaHCO3溶液中 | Mg与NaHCO3溶液剧烈反应 | |
| 3 | 将镁条投入5ml pH=8.4NaOH溶液中 | 现象不明显 | Mg与NaOH溶液较难反应 |
假设一:只有CO2;假设二:只有H2;假设三:H2和CO2
为检验其中是否含有CO2,写出实验步骤和结论.
实验步骤 | 想象和结论 |
| 大试管中加入擦去氧化膜的镁条 加入碳酸氢钠饱和溶液,用湿润的红色石蕊试纸在锥形瓶口检验 | 若试纸变红,气体中有CO2若试纸不变红,气体中无CO2 |
 研究CO2的利用对促进低碳社会的构建具有重要意义.
研究CO2的利用对促进低碳社会的构建具有重要意义. CO(NH2)2+H2O.时氨碳比=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.
CO(NH2)2+H2O.时氨碳比=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%. 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.根据掌握的信息分析,装箱区的危险化学品可能有钾、钠、氯酸钠、硝酸钾、烧碱,硫化碱、硅化钙、三氯乙烯、氯碘酸等.运抵区的危险化学品可能有环己胺、二甲基二硫、甲酸、硝酸铵、氰化钠、4,6-二硝基苯-邻仲丁基苯酚等.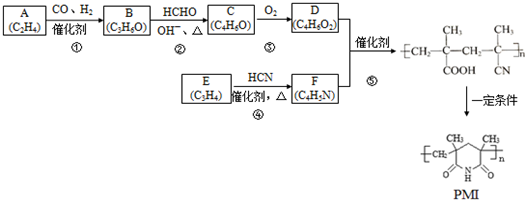
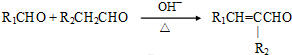 (注:R1可以是烃基本,也可以是H原子)
(注:R1可以是烃基本,也可以是H原子)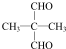 .
.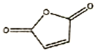 和
和 反应可制备
反应可制备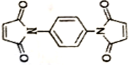 .然后以
.然后以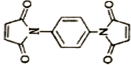 为单体发生聚合反应可合成另一种聚亚酰胺树脂X.该聚合反应的化学方程式为:n
为单体发生聚合反应可合成另一种聚亚酰胺树脂X.该聚合反应的化学方程式为:n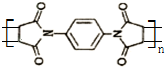 (X中无碳碳双键)
(X中无碳碳双键)