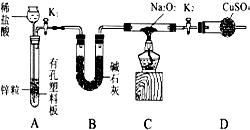
题目内容
2.某实验室小组偶然发现将镁条插入饱和NaHCO3溶液中,镁条表面出现大量气泡.为了探究产生此现象的原因,该小组设计实验探究如下:(1)用固体NaHCO3配置饱和NaHCO3溶液的操作过程在烧杯中加入足量碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可.饱和NaHCO3溶液pH=8.4,用离子方程式表示HCO3-+H2O?H2CO3+OH-.
(2)请完成以下实验设计(镁条已擦去氧化膜且表面积大致相同.表中不要留空格):
序号 | 实验操作 | 实验现象 | 实验结论 |
| 1 | 将镁条投入5ml蒸馏水 | 微量气泡 | |
| 2 | 将镁条投入5ml饱和NaHCO3溶液中 | Mg与NaHCO3溶液剧烈反应 | |
| 3 | 将镁条投入5ml pH=8.4NaOH溶液中 | 现象不明显 | Mg与NaOH溶液较难反应 |
假设一:只有CO2;假设二:只有H2;假设三:H2和CO2
为检验其中是否含有CO2,写出实验步骤和结论.
实验步骤 | 想象和结论 |
| 大试管中加入擦去氧化膜的镁条 加入碳酸氢钠饱和溶液,用湿润的红色石蕊试纸在锥形瓶口检验 | 若试纸变红,气体中有CO2若试纸不变红,气体中无CO2 |
分析 (1)配制饱和溶液,只要溶液中有没有溶解的固体NaHCO3,溶液饱和;饱和NaHCO3溶液pH=8.4,是因为HCO3-的水解程度大于其电离程度;
(2)1.据实验现象为微量气泡判断实验结论为镁和水反应缓慢;
2.据Mg与NaHCO3溶液剧烈反应判断实验现象,用反应生成气体;
3.Mg与NaOH溶液较难反应用选取和碳酸氢钠PH相同的氢氧化钠溶液对比分析;
(3)Mg与NaHCO3溶液反应,可能生成二氧化碳和氢气,据此分析.
解答 解:(1)配制饱和NaHCO3溶液,在烧杯中加入足量的碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可;饱和NaHCO3溶液pH=8.4,是因为HCO3-的水解大于其电离,其水解的离子方程式为:HCO3-+H2O?H2CO3+OH-,
故答案为:在烧杯中加入足量的碳酸氢钠固体,加入适量蒸馏水,加热使之溶解,冷却后取上层清液即可;HCO3-+H2O?H2CO3+OH-;
(2)1.实验现象为微量气泡,说明Mg与蒸馏水缓慢反应,
2.Mg与NaHCO3溶液剧烈反应,可知镁表面出现大量气泡,
3.依据实验设计,验证Mg与NaOH溶液较难反应,可以取用PH=8.4的氢氧化钠溶液和PH=8.4的碳酸氢钠对比实验判断,镁和氢氧化钠溶液不反应,
故答案为:
| 序号 | 实验操作 | 实验现象 | 实验结论 |
| 1 | Mg与蒸馏水缓慢反应 | ||
| 2 | 镁表面出现大量气泡 | ||
| 3 | 8.4 |
| 实验步骤 | 想象和结论 |
| 加入碳酸氢钠饱和溶液,用湿润的红色石蕊试纸在锥形瓶口检验 | 若试纸变红,气体中有CO2若试纸不变红,气体中无CO2 |
点评 本题考查了饱和溶液的配制、水解离子方程式书写、实验现象的分析判断、气体的检验,注意实验对比判断物质性质,题目难度中等.

练习册系列答案
相关题目
13.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | pH=1的NaHSO4溶液:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 向10mL pH=l2的NaOH溶液中滴加等体积pH=2的CH3COOH:c(CH3COO-)>c(Na+)>c(OH-)>C(H+) | |
| C. | 0.10 mol•L-1 NaHCO3溶液加水稀释后,n (H+)与n (OH-)的乘积变大 | |
| D. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合溶液显碱性:c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
17.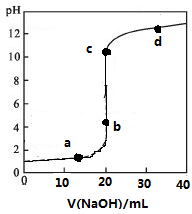 常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
 常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )| A. | 可选酚酞或甲基橙作指示剂 | |
| B. | 滴定前HR溶液中存在大量HR分子 | |
| C. | V=20 mL时,溶液中水电离的:c(H+)×c(OH-)=1×10-14mol2/L2 | |
| D. | c点时溶液中离子浓度大小关系有c(Na+)>c(R-)>c(OH-)>c(H+) |
7.人类文明的发展历程,也是化学物质的认识和发现的历程,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界.
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为8,基态铁原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d5.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式SO3等.
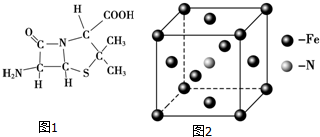
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.
(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(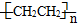 )分子中有5n个σ键
)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60gSiO2放出的能量为(2c-a-b) kJ
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该反应的化学方程式8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2,若两个最近的Fe原子间的距离为s cm,则该晶体的密度是$\frac{119\sqrt{2}}{2{s}^{3}{N}_{A}}$g•cm-3.
(1)Fe单质为体心立方晶体,晶胞中铁原子的配位数为8,基态铁原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d5.
(2)硝酸钾中NO3-的空间构型为平面正三角形,写出与NO3-互为等电子体的一种非极性分子化学式SO3等.
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(
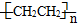 )分子中有5n个σ键
)分子中有5n个σ键d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60gSiO2放出的能量为(2c-a-b) kJ
| 化学键 | Si-Si | O═O | Si-O |
| 键能(kJ•mol-1) | a | b | c |
14.海水是宝贵的自然资源,将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.
(1)采用“空气吹出法”从浓海水吹出 Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是 Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收 0.15mol Br电子为0.25 mol.
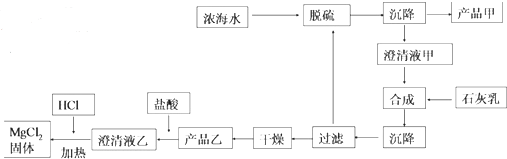
(2)海水提镁的一段
工艺流程如图:
浓海水的主要成分如表:
①该工艺过程中,脱硫阶段主要的离子方程式为Ca2++SO42-=CaSO4↓,加入石灰乳时所发生的离子方程式是Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+
②产品乙的化学式为Mg(OH)2,1L 浓海水最多可得到产品乙的质量是69.9g
③在制备 MgCl2固体时,通入 HCl 气体的目的是抑制氯化镁水解.
(1)采用“空气吹出法”从浓海水吹出 Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是 Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收 0.15mol Br电子为0.25 mol.
(2)海水提镁的一段
工艺流程如图:

浓海水的主要成分如表:
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②产品乙的化学式为Mg(OH)2,1L 浓海水最多可得到产品乙的质量是69.9g
③在制备 MgCl2固体时,通入 HCl 气体的目的是抑制氯化镁水解.
17.在溶液中能大量共存的离子组是( )
| A. | H+、OH-、Na+、Cl- | B. | K+、NO3-、Cu2+、Cl- | ||
| C. | Ba2+、SO42-、Na+、OH- | D. | Fe3+、OH-、NH4+、HCO3- |

 A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.