题目内容
8. 研究CO2的利用对促进低碳社会的构建具有重要意义.
研究CO2的利用对促进低碳社会的构建具有重要意义.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
已知:①Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①该反应的平衡常数表达式为K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$.
②取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H<0(填“>”、“<”或“=”).
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”、“<”或“=”).判断的理由由于温度高,CH3OH含量低,说明化学平衡常数KⅠ>KⅡ.
(3)以CO2为原料还可以合成多种物质.
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为2NH3+CO2
 CO(NH2)2+H2O.时氨碳比=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.
CO(NH2)2+H2O.时氨碳比=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Kb=4.3×10-7,则NH4HCO3溶液呈碱性(填“酸性”、“中性”、“碱性”).
分析 (1)根据盖斯定律,①-②×3可得:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);
(2)①化学平衡常数是可逆反应达到平衡状态时各种生成物浓度的化学计量数幂指数的乘积与各种反应物浓度的化学计量数幂指数的乘积的比;
②由甲醇的体积分数φ(CH3OH)与反应温度T的关系图示可知:当反应达到平衡后,升高温度,甲醇的体积分数减小,说明升高温度,化学平衡逆向移动;
③曲线Ⅱ比I先达到平衡,说明曲线Ⅱ的反应速率快,平衡时曲线Ⅱ甲醇的物质的量较小,说明平衡向逆反应进行,由于正反应为气体体积减小的反应,不能是增大压强,说明温度曲线Ⅱ>I,由于温度高,CH3OH含量低,说明化学平衡常数减小;
(3)①由CO2和NH3在一定条件下合成尿素[CO(NH2)2],根据质量守恒定律书写方程式;
假设n(CO2)=1 mol,则n(NH3)=3mol.由于达平衡时CO2的转化率为60%,所以反应消耗的n(CO2)=0.6 mol,根据方程式可知反应的NH3的物质的量,进而计算氨气的转化率;
②根据电离常数可知HCO3-水解强于NH4+水解,故显弱碱性.
解答 解:(1)已知:①Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
根据盖斯定律,①-②×3可得:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$,
故答案为:$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$;
②由甲醇的体积分数φ(CH3OH)与反应温度T的关系图示可知:当反应达到平衡后,升高温度,甲醇的体积分数减小,说明升高温度,化学平衡逆向移动,升高温度平衡向吸热反应方向移动,逆反应方向为吸热反应,所以正反应为放热反应,所以△H<0,
故答案为:<;
③曲线Ⅱ比I先达到平衡,说明曲线Ⅱ的反应速率快,平衡时曲线Ⅱ甲醇的物质的量较小,说明平衡向逆反应进行,由于正反应为气体体积减小的反应,不能是增大压强,说明温度曲线Ⅱ>I,由于温度高,CH3OH含量低,说明化学平衡常数KⅠ>KⅡ,
故答案为:>;由于温度高,CH3OH含量低,说明化学平衡常数KⅠ>KⅡ;
(3)①根据质量守恒定律,由CO2和NH3在一定条件下合成尿素[CO(NH2)2]的反应方程式为:2NH3+CO2 CO(NH2)2+H2O,
CO(NH2)2+H2O,
假设n(CO2)=1 mol,则n(NH3)=3mol,由于达平衡时CO2的转化率为60%,所以反应消耗的n(CO2)=0.6 mol,根据方程式可知反应的NH3的物质的量n(NH3)=1.2 mol,所以氨气的转化率为(1.2 mol÷3mol)×100%=40%,
故答案为:2NH3+CO2 CO(NH2)2+H2O;40%;
CO(NH2)2+H2O;40%;
②一水合氨的电离常数大于HCO3-的电离常数,可知HCO3-水解程度强于NH4+水解程度,故NH4HCO3溶液呈弱碱性,故答案为:碱性.
点评 本题考查化学平衡有关计算及影响因素、热化学方程式书写、电离平衡常数等,是对学生综合能力的考查,难度中等.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案| A. | 电解食盐水制烧碱 | B. | 合成氨中的催化合成 | ||
| C. | 硫酸生产中的催化氧化 | D. | 氨碱法中的氨盐水碳酸化 |
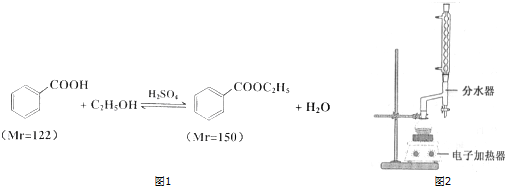
已知:
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
①在100mL圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按图2所示连接好仪器,并在分水器中预先加入水,使水面略低于分水器的支管口,控制温度在65~70℃加热回流2h.反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来.在反应过程中,通过分水器下部的旋塞分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续
加 热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏,低温蒸出乙醚后,继续升温,接收210~213℃的馏分.
⑤检验合格,测得产品体积为12.86mL.
回答下列问题:
(1)步骤①中使用分水器不断分离除去水的目的是分离产生的水,使平衡向正反应方向移动,提高转化率.
(2)反应结束的标志是分水器中的水层不再增加时,视为反应的终点.
(3)步骤②中应控制馏分的温度在C.
A.65~70℃B.78~80℃C.85~90℃D.215~220℃
(4)若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是苯甲酸乙酯中混有未除净的苯甲酸,在受热至100℃时发生升华.
(5)关于步骤④中的分液操作叙述正确的是AD.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞.将分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,需将玻璃塞上的凹槽对准漏斗口上的小孔
(6)蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有蒸馏烧瓶,温度计.
(7)该实验的产率为90%.
| A. | pH=1的NaHSO4溶液:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 向10mL pH=l2的NaOH溶液中滴加等体积pH=2的CH3COOH:c(CH3COO-)>c(Na+)>c(OH-)>C(H+) | |
| C. | 0.10 mol•L-1 NaHCO3溶液加水稀释后,n (H+)与n (OH-)的乘积变大 | |
| D. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合溶液显碱性:c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
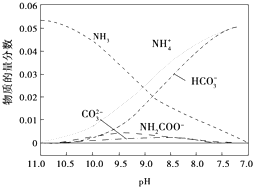
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)═2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成 | |
| D. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 |
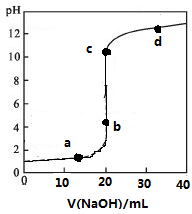 常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )| A. | 可选酚酞或甲基橙作指示剂 | |
| B. | 滴定前HR溶液中存在大量HR分子 | |
| C. | V=20 mL时,溶液中水电离的:c(H+)×c(OH-)=1×10-14mol2/L2 | |
| D. | c点时溶液中离子浓度大小关系有c(Na+)>c(R-)>c(OH-)>c(H+) |
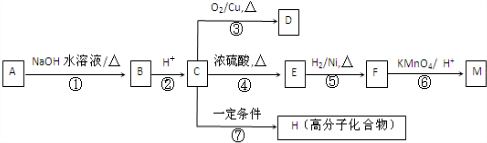
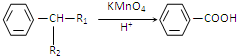 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)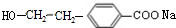 、
、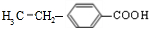 ;
; ;反应⑦的化学方程式为
;反应⑦的化学方程式为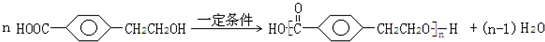 .
.