题目内容
17.某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是( )| A. | Zn为电池的负极 | |
| B. | 正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O | |
| C. | 该电池放电过程中电解质溶液浓度不变 | |
| D. | 电池工作时OH-向负极迁移 |
分析 某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,原电池发生工作时,发生反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH,Zn被氧化,为原电池的负极,K2FeO4具有氧化性,为正极,碱性条件下被还原生成Fe(OH)3,结合电极方程式以及离子的定向移动解答该题.
解答 解:A.根据化合价升降判断,Zn化合价只能上升,故为负极材料,K2FeO4为正极材料,故A正确;
B.KOH溶液为电解质溶液,则正极电极方程式为2FeO42-+6e-+8H2O=2Fe(OH)3+10OH-,故B错误;
C.总方程式为3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH,生成KOH,则该电池放电过程中电解质溶液浓度增大,故C错误;
D.电池工作时阴离子OH-向负极迁移,故D正确.
故选AD.
点评 本题考查原电池知识,为2016年海南高考题,侧重考查学生的分析能力,题目较为基础,注意从元素化合价的角度分析,把握原电池与氧化还原反应的关系,难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
7.化学是你,化学是我,化学深入我们生活,下列有关说法不正确的是( )
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
5.下列说法正确的是( )
| A. | 将造纸废水通过高压水井压到地下或溶洞中,可减少污染 | |
| B. | 煤的气化和液化能提高煤的利用率、减少污染 | |
| C. | 氯碱工业中的“碱”指的是Na2CO3 | |
| D. | 煤的干馏、石油的分馏为物理变化 |
12.向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是( )
| A. | c(CO32-) | B. | c(Mg2+) | C. | c(H+) | D. | Ksp(MgCO3) |
9.下列单元操作中采用了热交换设计的有( )
| A. | 电解食盐水制烧碱 | B. | 合成氨中的催化合成 | ||
| C. | 硫酸生产中的催化氧化 | D. | 氨碱法中的氨盐水碳酸化 |
17.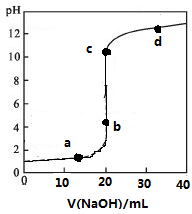 常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
 常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )| A. | 可选酚酞或甲基橙作指示剂 | |
| B. | 滴定前HR溶液中存在大量HR分子 | |
| C. | V=20 mL时,溶液中水电离的:c(H+)×c(OH-)=1×10-14mol2/L2 | |
| D. | c点时溶液中离子浓度大小关系有c(Na+)>c(R-)>c(OH-)>c(H+) |

 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)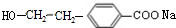 、
、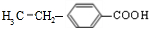 ;
; ;反应⑦的化学方程式为
;反应⑦的化学方程式为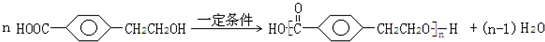 .
.
