题目内容
5.雾霾是雾和霾的混合物,在空气中能形成溶胶,PM2.5是“罪魁”.下列有关说法不正确的是( )| A. | 雾霾的形成与化石燃料的燃烧有关 | |
| B. | 海南不存在雾霾天气,无需防治PM2.5的污染 | |
| C. | 在雾霾天气中行车,打开车灯可观察到丁达尔效应 | |
| D. | 调整工业能源结构,推广清洁能源的使用,能有效地减少PM2.5的污染 |
分析 A.化石燃料的燃烧能够产生大量微小尘粒、烟粒或盐粒等颗粒悬浮物;
B.海南存在雾霾天气,只不过较少;
C.雾霾能形成气溶胶,胶体具有丁达尔效应;
D.清洁能源的使用能够减少化石燃料的燃烧,减少烟尘等颗粒物排放;
解答 解:A.化石燃料的燃烧能够产生大量微小尘粒、烟粒或盐粒等颗粒悬浮物而形成雾霾,故A正确;
B.海南存在雾霾天气,只不过较少,仍然需要防治PM2.5的污染,故B错误;
C.雾霾能形成气溶胶,胶体具有丁达尔效应,所以在雾霾天气中行车,打开车灯可观察到丁达尔效应,故C正确;
D.调整工业能源结构,推广清洁能源的使用,能够减少化石燃料的燃烧,减少烟尘等颗粒物排放,能有效地减少PM2.5的污染,故D正确;
故选:B.
点评 本题考查了环境污染与治理,侧重考查pM2.5及雾霾的考查,明确污染源及治理方法是解题关键,有利于培养学生环境保护的意识,题目难度不大.

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 将造纸废水通过高压水井压到地下或溶洞中,可减少污染 | |
| B. | 煤的气化和液化能提高煤的利用率、减少污染 | |
| C. | 氯碱工业中的“碱”指的是Na2CO3 | |
| D. | 煤的干馏、石油的分馏为物理变化 |
13.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | pH=1的NaHSO4溶液:c(Na+)+c(H+)=c(SO42-)+c(OH-) | |
| B. | 向10mL pH=l2的NaOH溶液中滴加等体积pH=2的CH3COOH:c(CH3COO-)>c(Na+)>c(OH-)>C(H+) | |
| C. | 0.10 mol•L-1 NaHCO3溶液加水稀释后,n (H+)与n (OH-)的乘积变大 | |
| D. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合溶液显碱性:c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) |
20.40℃,在氨水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )
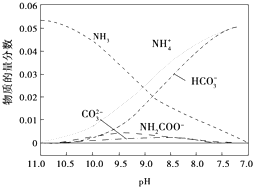

| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)═2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成 | |
| D. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 |
17.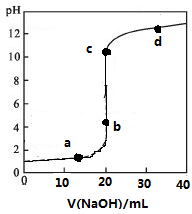 常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
 常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )| A. | 可选酚酞或甲基橙作指示剂 | |
| B. | 滴定前HR溶液中存在大量HR分子 | |
| C. | V=20 mL时,溶液中水电离的:c(H+)×c(OH-)=1×10-14mol2/L2 | |
| D. | c点时溶液中离子浓度大小关系有c(Na+)>c(R-)>c(OH-)>c(H+) |
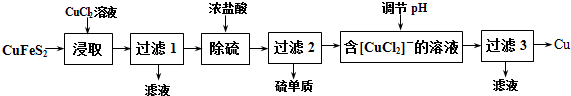
14.海水是宝贵的自然资源,将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一.
(1)采用“空气吹出法”从浓海水吹出 Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是 Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收 0.15mol Br电子为0.25 mol.
(2)海水提镁的一段
工艺流程如图:
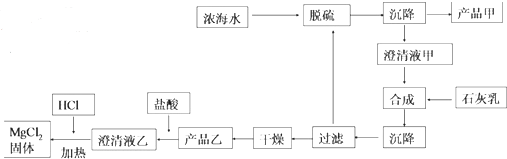
浓海水的主要成分如表:
①该工艺过程中,脱硫阶段主要的离子方程式为Ca2++SO42-=CaSO4↓,加入石灰乳时所发生的离子方程式是Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+
②产品乙的化学式为Mg(OH)2,1L 浓海水最多可得到产品乙的质量是69.9g
③在制备 MgCl2固体时,通入 HCl 气体的目的是抑制氯化镁水解.
(1)采用“空气吹出法”从浓海水吹出 Br2,并用纯碱吸收,这样做的目的是使Br2富集;碱吸收溴的主要反应是 Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,吸收 0.15mol Br电子为0.25 mol.
(2)海水提镁的一段
工艺流程如图:

浓海水的主要成分如表:
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②产品乙的化学式为Mg(OH)2,1L 浓海水最多可得到产品乙的质量是69.9g
③在制备 MgCl2固体时,通入 HCl 气体的目的是抑制氯化镁水解.

 A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中的前20号元素,原子序数依次增大,B、C、D同周期,A、D原子中某p能级均排有5个电子,E和其他元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水.