题目内容
16. 某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,如表是他们撰写的实验报告的一部分.
某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,如表是他们撰写的实验报告的一部分. | 实验序号 | 实验步骤(内容) | 现象 |
| ① | 在贴有标签a、b的试管中分别加入1.0gNa2CO3固体和NaHCO3固体,观察外观. | / |
| ② | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象. | / |
| ③ | 再分别向两试管中滴加2滴酚酞溶液,观察现象. | 溶液变红 |
| ④ | 加热大试管一段时间.(注:棉花球沾有无水硫酸铜粉末) | 有无水硫酸铜粉末的棉花球变蓝,A烧杯中没有明显现象,B烧杯中有白色沉淀生成 |
(2)已知:20℃时Na2CO3的溶解度为20.5g.由实验②(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是白色晶体析出,化学方程式是Na2CO3+CO2+H2O=2NaHCO3↓.
(3)由实验④可以得出结论是碳酸钠的稳定性强于碳酸氢钠,用化学方程式说明得出结论的原因2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
分析 (1)碳酸氢钠加热分解有水生成,无水硫酸铜遇水变蓝;碳酸钠加热不分解;
(2)实验②中可比较溶解度大小,向饱和Na2CO3溶液中不断通入CO2气体,反应生成溶解度更小的碳酸氢钠;
(3)由实验④可知,碳酸钠稳定,碳酸氢钠加热分解.
解答 解:(1)④中Na2CO3的热稳定性强于NaHCO3,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,无水CuSO4遇H2O变蓝,产生的CO2能使澄清石灰水变浑浊,因此现象是棉花球变蓝,A烧杯中没有明显现象,B烧杯中有白色沉淀产生,
故答案为:沾有无水硫酸铜粉末的棉花球变蓝,A烧杯中没有明显现象,B烧杯中有白色沉淀生成;
(2)溶解度的高低需要看加水溶解的情况,因此实验②说明了溶解度的高低;Na2CO3+CO2+H2O=2NaHCO3↓,饱和碳酸钠转变成了碳酸氢钠,因为碳酸钠的溶解度大于碳酸氢钠的溶解度,因此有白色晶体析出,
故答案为:②;白色晶体析出;Na2CO3+CO2+H2O=2NaHCO3↓;
(3)根据实验现象,棉花球变蓝,说明产生了水,烧杯变浑浊,说明生成了CO2,说明碳酸钠的稳定性强于碳酸氢钠,因此反应方程式:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,故答案为:碳酸钠的稳定性强于碳酸氢钠;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
点评 本题考查性质实验方案的设计,为高频考点,把握物质的性质、反应原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
4.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 长期大量使用(NH4)2SO4化肥会使土壤酸化,而使用尿素[CO(NH2)2]则不会改变土壤酸碱性 | |
| B. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| C. | 普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料 | |
| D. | 氟氯烃是安全、环保的制冷剂 |
11.40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-) | |
| B. | 如图随着CO2的通入,$\frac{{c(OH}^{-})}{{c(NH}_{3}•{H}_{2}O)}$不断减小 | |
| C. |  在如图所示不同pH的溶液中一定存在关系:c(NH4+)≥2c(CO32-)+c(HCO3-)+c(NH2COO-) | |
| D. | 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成 |
1.无水硫酸亚铁是白色粉末,溶于水,水溶液为浅绿色,常见其七水合物(绿矾FeSO4•7H2O ),在潮湿空气中易氧化成难溶于水的棕黄色碱式硫酸铁Fe(OH)SO4.主要用于净水、照相制版及治疗缺铁性贫血等.
某化学兴趣小组欲确定某FeSO4•7H2O样品加热后的产物,实验步骤如下:
①检查装置的气密性;②称取2.78g样品,置于B试管中;③打开活塞K,从C处通入某种气体;④关闭K,对试管B充分加热;⑤打开活塞K,从C处再通入该气体.
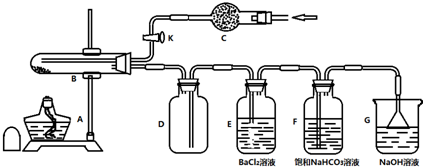
(1)E中产生白色沉淀,说明FeSO4•7H2O分解有SO3生成.
(2)步骤③中从C处通入的气体作用为将装置中的空气全部赶出,并将FeSO4•7H2O的分解产物全部排出,该气体可以为C.
A.SO2 B.Cl2 C.N2 D.NH3
若不通入气体,则E中发生的副反应为2SO2+O2+2BaCl2+2H2O=2BaSO4↓+4HCl.
(3)甲同学将F中反应后溶液共100mL取出,用0.020mol•L-1的酸性KMnO4溶液进行滴定,KMnO4溶液应盛装在酸式滴定管中.滴定过程中反应的离子方程式为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O;滴定完毕,三次实验记录KMnO4标准溶液的读数如下:
通过计算,甲同学认为B中的固体产物化学式为Fe2O3.
(4)设计实验证明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解:取少量FeSO4•7H2O水溶液于试管中,先加Fe粉,再滴入几滴石蕊试液,试管中溶液微红,然后加热试管中的溶液,若溶液红色加深,则说明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解.
某化学兴趣小组欲确定某FeSO4•7H2O样品加热后的产物,实验步骤如下:
①检查装置的气密性;②称取2.78g样品,置于B试管中;③打开活塞K,从C处通入某种气体;④关闭K,对试管B充分加热;⑤打开活塞K,从C处再通入该气体.

(1)E中产生白色沉淀,说明FeSO4•7H2O分解有SO3生成.
(2)步骤③中从C处通入的气体作用为将装置中的空气全部赶出,并将FeSO4•7H2O的分解产物全部排出,该气体可以为C.
A.SO2 B.Cl2 C.N2 D.NH3
若不通入气体,则E中发生的副反应为2SO2+O2+2BaCl2+2H2O=2BaSO4↓+4HCl.
(3)甲同学将F中反应后溶液共100mL取出,用0.020mol•L-1的酸性KMnO4溶液进行滴定,KMnO4溶液应盛装在酸式滴定管中.滴定过程中反应的离子方程式为:2MnO4-+5SO32-+6H+=2Mn2++5SO42-+3H2O;滴定完毕,三次实验记录KMnO4标准溶液的读数如下:
| 滴定次数实验数据 | 1 | 2 | 3 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 |
| V(KMnO4)/mL(初读数) | 1.50 | 0.20 | 0.00 |
| V(KMnO4)/mL(终读数) | 19.85 | 20.22 | 19.98 |
(4)设计实验证明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解:取少量FeSO4•7H2O水溶液于试管中,先加Fe粉,再滴入几滴石蕊试液,试管中溶液微红,然后加热试管中的溶液,若溶液红色加深,则说明FeSO4•7H2O水溶液呈酸性的原因是Fe2+的水解.
 度为cmol/L那么下列关系式正确的是( )
度为cmol/L那么下列关系式正确的是( )
