题目内容
4.化学与生产、生活密切相关,下列说法正确的是( )| A. | 长期大量使用(NH4)2SO4化肥会使土壤酸化,而使用尿素[CO(NH2)2]则不会改变土壤酸碱性 | |
| B. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| C. | 普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料 | |
| D. | 氟氯烃是安全、环保的制冷剂 |
分析 A.尿素[CO(NH2)2]中的氨基具有碱性;
B.硫酸亚铁片和维生素C同时服用,可防止亚铁离子被氧化;
C.有机玻璃的成分为聚丙烯酸甲酯;
D.氟氯烃制冷剂会导致臭氧层被破坏.
解答 解:A.(NH4)2SO4化肥中的铵根离子水解显示酸性,能使土壤酸化,尿素[CO(NH2)2]中的氨基具有碱性,会使土壤碱化,故A错误;
B.硫酸亚铁片和维生素C同时服用,可防止亚铁离子被氧化,所以能增强治疗缺铁性贫血的效果,故B正确;
C.普通玻璃中含硅酸盐等属于无机非金属材料,而有机玻璃的成分为聚丙烯酸甲酯,为有机高分子材料,故C错误;
D.氟氯烃制冷剂会导致臭氧层被破坏,减少紫外线的吸收,增大紫外线对人类健康的影响,会造成环境污染,故D错误;
故选B.
点评 本题考查物质的性质、应用,为高频考点,把握物质的性质、发生的反应、性质与用途等为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
9.短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A. | B与A只能组成BA3化合物 | |
| B. | C、D、E形成的化合物与稀硫酸可能发生氧化还原反应 | |
| C. | A、B、C形成的化合物一定不能发生水解 | |
| D. | E的氧化物一定有强的氧化性 |
16. 某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,如表是他们撰写的实验报告的一部分.
某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,如表是他们撰写的实验报告的一部分.
(1)请帮助该小组同学完成实验报告中放入内容有无水硫酸铜粉末的棉花球变蓝,A烧杯中没有明显现象,B烧杯中有白色沉淀生成.
(2)已知:20℃时Na2CO3的溶解度为20.5g.由实验②(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是白色晶体析出,化学方程式是Na2CO3+CO2+H2O=2NaHCO3↓.
(3)由实验④可以得出结论是碳酸钠的稳定性强于碳酸氢钠,用化学方程式说明得出结论的原因2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
 某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,如表是他们撰写的实验报告的一部分.
某小组同学通过对比实验了解Na2CO3和NaHCO3性质的异同,如表是他们撰写的实验报告的一部分. | 实验序号 | 实验步骤(内容) | 现象 |
| ① | 在贴有标签a、b的试管中分别加入1.0gNa2CO3固体和NaHCO3固体,观察外观. | / |
| ② | 继续向两试管中分别加入10.0mL水,用力振荡,观察现象. | / |
| ③ | 再分别向两试管中滴加2滴酚酞溶液,观察现象. | 溶液变红 |
| ④ | 加热大试管一段时间.(注:棉花球沾有无水硫酸铜粉末) | 有无水硫酸铜粉末的棉花球变蓝,A烧杯中没有明显现象,B烧杯中有白色沉淀生成 |
(2)已知:20℃时Na2CO3的溶解度为20.5g.由实验②(填实验序号)现象可知,20℃时NaHCO3的溶解度小于20.5g;如果向饱和Na2CO3溶液中不断通入CO2气体,现象是白色晶体析出,化学方程式是Na2CO3+CO2+H2O=2NaHCO3↓.
(3)由实验④可以得出结论是碳酸钠的稳定性强于碳酸氢钠,用化学方程式说明得出结论的原因2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
13.原电池是能把化学能转变成电能的装置,下列关于Zn-Cu(H2SO4)原电池的说法中错误的是( )
| A. | 负极:Zn-2e-═Zn2+(氧化反应) | B. | 正极:O2+2H2O+4e-═4OH-(还原反应) | ||
| C. | 电流流向:Cu→Zn | D. | 正极:2H++2e-═H2↑(还原反应) |
11.下列试剂在空气中变质不是因为空气中的氧气的作用而变质的是( )
| A. | 氢氧化钠 | B. | 亚硫酸钠 | C. | 氯化亚铁 | D. | 苯酚 |


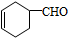 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键.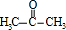 .
. .
.