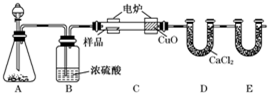
题目内容
2.对于ⅣA族元素,下列叙述中不正确的是( )| A. | CO2在常温下是气体,SiO2在常温下是固体 | |
| B. | C、Si、Ge的最外层电子数都是4,次外层电子数都是8 | |
| C. | CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 | |
| D. | 该族元素的主要化合价是+4和+2 |
分析 A、二氧化碳是分子晶体,而二氧化硅是原子晶体;
B、根据各原子的结构示意图可判断;
C、根据酸性氧化物的通性;
D、根据碳族元素的最外层电子数判断.
解答 解:A、二氧化碳是分子晶体,常温下是气体,而二氧化硅是原子晶体,常温下是固体,故A正确;
B、最外层都是4,但是C次外层不是8,故B错误;
C、酸性氧化物和碱性氧化物一定条件可以反应,故C正确;
D、碳族元素的最外层电子数为4,所以最高正价为+4价,当然也能形成+2价,故D正确;
故选:B.
点评 同一主族,从上到下,元素的最外层电子数相同,性质相似,具有递变性.

练习册系列答案
相关题目
20.雷复尼特(结构是如图)是一种抗吸血虫病药,下列有关叙述不正确的是( )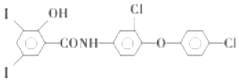

| A. | 与浓硫酸共热,有紫色气体产生 | B. | 分子中所有原子有可能在同一平面 | ||
| C. | 1mol只能与2molNaOH反应 | D. | 可使酸性高锰酸钾溶液褪色 |
17.醋酸镍[(CH3COO)2Ni]是一种重要的化工原料.一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料制取醋酸镍的工艺流程图如图1:

相关离子生成氢氧化物的pH和相关物质的溶解性如表:
(1)NH4F的电子式为
(2)将含镍原料粉碎的目的是提高镍的浸出率
(3)调节pH步骤中,溶液pH的调节范围是5.0≤pH<6.7.
(4)滤渣1和滤渣3主要成分的化学式分别是SiO2、CaSO4、CaF2.
(5)写出氧化步骤中加入H2O2发生反应的离子方程式2Fe2++H2O2+2H+═2Fe3++2H2O.
(6)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体.写出该反应的化学方程式:NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O.
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图2.酸浸的最佳温度与时间分别为70℃、120min.
(8)沉镍过程中,若c(Ni2+)=2.0mol•L-1,欲使100mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol•L-1],则需要加入Na2CO3固体的质量最少为31.8g.(保留小数点后1位有效数字).

相关离子生成氢氧化物的pH和相关物质的溶解性如表:
| 金属离子 | 开始沉淀时的pH | 沉淀完全时的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
| 物质 | 20℃时溶解性(H2O) |
| CaSO4 | 微溶 |
| NiF | 可溶 |
| CaF | 难溶 |
| NiCO3 | Ksp=1.0×10-6 |

(2)将含镍原料粉碎的目的是提高镍的浸出率
(3)调节pH步骤中,溶液pH的调节范围是5.0≤pH<6.7.
(4)滤渣1和滤渣3主要成分的化学式分别是SiO2、CaSO4、CaF2.
(5)写出氧化步骤中加入H2O2发生反应的离子方程式2Fe2++H2O2+2H+═2Fe3++2H2O.
(6)酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体.写出该反应的化学方程式:NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O.
(7)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图2.酸浸的最佳温度与时间分别为70℃、120min.
(8)沉镍过程中,若c(Ni2+)=2.0mol•L-1,欲使100mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol•L-1],则需要加入Na2CO3固体的质量最少为31.8g.(保留小数点后1位有效数字).
7.已知C(石墨)→C(金刚石)-Q,则可以判断( )
| A. | 金刚石比石墨稳定 | B. | 石墨比金刚石稳定 | ||
| C. | 一样稳定 | D. | 无法判断 |
14.根据下列实验操作和现象所得结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| B | 向浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
| C | 取少量淀粉水解液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,出现砖红色沉淀 | 淀粉已完全水解 |
| D | 在CuSO4溶液中加入KI溶液,再加入苯,振荡,有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| A. | A | B. | B | C. | C | D. | D |
11.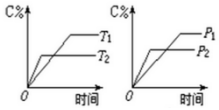 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )| A. | 达平衡后,若升温,则K减小 | |
| B. | 达平衡后,加入催化剂C%增大 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,若增加A的量,B的转化率增大 |
12.甲、乙、丙三种物质是某抗生素合成过程中的中间产物,下列说法正确的是( )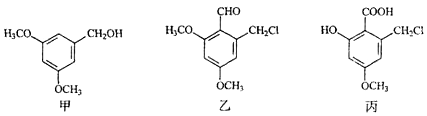

| A. | 甲、乙均能发生加成反应 | |
| B. | 甲的一种同分异构体中可能含有苯环和羧基 | |
| C. | 甲分子中的所有原子可能共平面 | |
| D. | 用酸性KMnO4溶液可鉴别乙和丙 |