题目内容
13.下列叙述正确的是( )| A. | 元素核外电子总倾向先排满能量较高的电子层,排满后排至能量较低的电子层? | |
| B. | 最外层电子数为1的元素一定是金属元素 | |
| C. | 原子核外M层最多容纳18个电子 | |
| D. | 镁原子与镁离子具有相同的电子层数 |
分析 A.原子核外电子的能量不同,能量低的在离核近的区域运动;
B.氢元素原子最外层由1个电子,属于非金属性;
C.原子核外每层最多容纳2n2个电子;
D.镁原子失去最外层电子后形成镁离子.
解答 解:A.原子核外电子的能量不同,能量低的在离核近的区域运动,所以元素核外电子总倾向先排满能量较低的电子层,排满后排至能量较高的电子层,故A错误;
B.氢元素原子最外层由1个电子,属于非金属性,所以最外层电子数为1的元素不一定是金属元素,故B错误;
C.原子核外每层最多容纳2n2个电子,则原子核外M层最多容纳18个电子,故C正确;
D.镁原子失去最外层电子后形成镁离子,镁原子核外3个电子层,镁离子核外2个电子层,故D错误.
故选C.
点评 本题考查原子结构和元素的性质,比较基础,主要考查周期表中元素的特殊性,注意对基础知识的积累掌握.

练习册系列答案
相关题目
3.二氧化氮能形成二聚分子:2NO2(g)?N2O4(g)正反应放热,现欲测定NO2分子的相对质量,应采取的措施是( )
| A. | 高温、低压 | B. | 低温、高压 | C. | 低温、低压 | D. | 高温、高压 |
4.草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
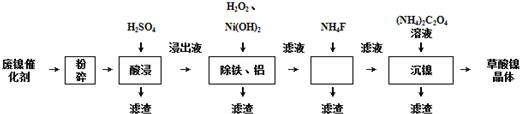
已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如表(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算).
(1)“粉碎”的目的是增大接触面积,加快反应速率,提高镍的浸出率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).

a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全;洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失,将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7,第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.

已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如表(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).

a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全;洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失,将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7,第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
1.下列各组的离子,能在溶液中大量共存的是( )
| A. | H+、Ca2+、Cl-、CO32- | B. | Na+、Mg2+、SO42-、OH- | ||
| C. | K+、Na+、Cl-、OH- | D. | Ba2+、Cu2+、Cl-、SO42- |
8.下列不属于抑酸剂的主要成分的是( )
| A. | 氧化镁 | B. | 氢氧化铜 | C. | 氢氧化铝 | D. | 小苏打 |
18.在一支50mL滴定管中盛入0.1mol/L HCl溶液,其液面恰好在20mL刻度处.若把滴定管中的溶液全部放入锥形瓶中,然后以0.1mol/L NaOH溶液进行滴定,当恰好中和时,消耗NaOH溶液的体积( )
| A. | 等于20 mL | B. | 等于30 mL | C. | 大于30 mL | D. | 小于20 mL |
2.下列离子方程式的书写正确的是( )
| A. | 以石墨作电极电解饱和氯化钠溶液:2Cl-+2H2O$\stackrel{电解}{→}$ 2OH-+H2↑+Cl2↑ | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+→Fe3++3H2O | |
| C. | H218O中投入少量Na2O2固体:2H218O+2O22-→4OH-+18O2↑ | |
| D. | CuCl2溶液中加入NaHS溶液:Cu2++HS-→CuS↓+H+ |
3.有3种溶液①0.01mol•L-1醋酸; ②0.02mol•L-1醋酸与0.02mol•L-1NaOH等体积混合后的溶液;③0.04mol•L-1醋酸与0.02mol•L-1 NaOH等体积混合后的溶液.下列说法不正确的是( )
| A. | 相同温度下,溶液中水的电离程度:溶液①<溶液② | |
| B. | 可用Na2CO3固体鉴别0.04mol•L-1醋酸和0.04mol•L-1盐酸 | |
| C. | 向①中加入少量CH3COONa固体,则$\frac{{K}_{a}}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 加水稀释溶液③,溶液中$\frac{c(C{H}_{3}COOH)•c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$不变 |

 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$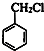 +HCl.
+HCl. 不能发生的化学反应是b(填序号).
不能发生的化学反应是b(填序号). (写出一种即可).
(写出一种即可). .
.