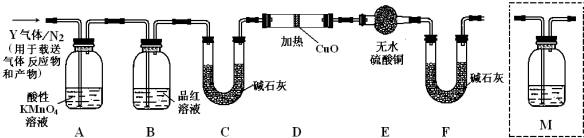
题目内容
4.草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下: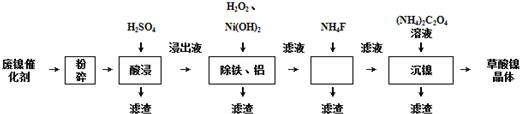
已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如表(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).

a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全;洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失,将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7,第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
分析 废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等),用硫酸溶解,SiO2不与硫酸反应,过滤得到滤液中含有NiSO4、FeSO4、Al2(SO4)3、CaSO4及过量的硫酸,加入H2O2将Fe2+氧化为Fe3+,加入Ni(HO)2调节pH,使pH大于5.0小于6.8,Fe3+转化为Fe(OH)3沉淀、Al3+转化为Al(OH)3沉淀,过滤除去,滤液中含有NiSO4、CaSO4,向滤液中加入NH4F,除去Ca 2+,过滤,再向滤液中加入(NH4)2C2O4,得到草酸镍沉淀,再过滤、洗涤、干燥得草酸镍晶体,
(1)把废镍催化剂粉碎,增大了反应的接触面积,加快反应速率,提高镍的浸出率;
(2)根据镍浸出率随时间变化图可知,70℃时,镍浸出率很大,从时间看,120min镍浸出率就已经很高了;
(3)“沉镍”工序中,可以用继续滴加(NH4)2C2O4溶液的方法,检验Ni2+是否沉淀完全,待溶液静置后,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全;“沉镍”工序生成了(NH4)2SO4,用乙醇洗涤,能洗去(NH4)2SO4杂质、便于烘干;
(4)为了除去铁、铝元素,取“浸出液”,用双氧水氧化二价铁为三价铁,再加入NaOH溶液,调节溶液5.0≤pH≤6.7,让Al3+、Fe3+沉淀完全,不能让Ni2+沉淀;根据Ksp(CaF2)=1.46×10-10<Ksp(CaC2O4)=2.34×10-9,加入适量NH4F溶液,生成CaF2,除去Ca2+;
(5)草酸镍晶体(NiC2O4•2H2O)在320℃分解得到Ni、CO2和H2O.
解答 解:(1)把废镍催化剂粉碎,增大了反应的接触面积,加快反应速率,提高镍的浸出率,
故答案为:增大接触面积,加快反应速率,提高镍的浸出率;
(2)根据镍浸出率随时间变化图可知,70℃时,镍浸出率很大,从时间看,120min镍浸出率就已经很高了,
故答案为:c;
(3)“沉镍”工序中,可以用继续滴加(NH4)2C2O4溶液的方法,检验Ni2+是否沉淀完全,待溶液静置后,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全;“沉镍”工序生成了(NH4)2SO4,用乙醇洗涤,能洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失,
故答案为:静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全;洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失;
(4)为了除去铁、铝元素,用双氧水氧化二价铁为三价铁,再加入NaOH溶液,调节溶液5.0≤pH≤6.7,让Al3+、Fe3+沉淀完全,不能让Ni2+沉淀;根据Ksp(CaF2)=1.46×10-10<Ksp(CaC2O4)=2.34×10-9,加入适量NH4F溶液,生成CaF2,除去Ca2+,
故答案为:5.0≤pH<6.7;除去杂质Ca2+;
(5)草酸镍晶体(NiC2O4•2H2O)在320℃分解得到Ni、CO2和H2O,反应的方程式为NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O;
故答案为:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
点评 本题考查了物质分离的实验设计和方法应用,主要是利用溶液不同pH条件下离子沉淀的情况不同,控制溶液PH除去杂质离子,得到较纯净的硫酸镍溶液来制备硫酸镍晶体,同时考查了除杂原则不能引入新的杂质,题目难度大

| A. | Zn 为正极,Ag2O 为负极 | |
| B. | 电解质溶液中,OH-移向 Ag2O 极 | |
| C. | 锌发生还原反应,氧化银发生氧化反应 | |
| D. | 原电池工作时,正极区溶液 pH 值增大 |
 ”分别表示不同元素的原子.下列各项中对图示模型理解正确的是( )
”分别表示不同元素的原子.下列各项中对图示模型理解正确的是( )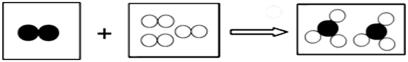
| A. | 该反应属于分解反应 | |
| B. | 反应中共有两种元素参与 | |
| C. | 反应物和生成物中只有一种单质 | |
| D. | 参加反应的两种物质分子个数之比为2:3 |
| A. | 元素核外电子总倾向先排满能量较高的电子层,排满后排至能量较低的电子层? | |
| B. | 最外层电子数为1的元素一定是金属元素 | |
| C. | 原子核外M层最多容纳18个电子 | |
| D. | 镁原子与镁离子具有相同的电子层数 |
| A. | 误将洁厕灵与消毒液混合:2H++Cl-+ClO-═Cl2↑+H2O | |
| B. | 玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| C. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
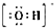 .
.
 ②白磷 ③2,3-二甲基丁烷 ④
②白磷 ③2,3-二甲基丁烷 ④