题目内容
N、S、K、Fe是四种常见的元素.
(1)Fe在周期表中的位置是 ;N基态原子有 个未成对电子;S基态原子电子排布式是 .
(2)在催化剂存在下,NH3可用来消除NO的污染,生成2种对环境无害的物质.写出该反应的化学方程式:
;该反应中氧化产物与还原产物的物质的量之比为 .
(3)16g S完全燃烧放出热量148.5kJ,硫燃烧热的热化学方程式为: .
(4)K2FeO4-Zn碱性电池反应为 2K2FeO4+3Zn+8H2O═2Fe(OH)3+3Zn(OH)2+4KOH则正极的电极反应式是 .
(5)K2FeO4常含有Na2FeO4杂质.取样品w g,测得Fe的物质的量为n mol,则该样品中K2FeO4的物质的量为 mol(用含w、n的代数式表示).
(1)Fe在周期表中的位置是
(2)在催化剂存在下,NH3可用来消除NO的污染,生成2种对环境无害的物质.写出该反应的化学方程式:
(3)16g S完全燃烧放出热量148.5kJ,硫燃烧热的热化学方程式为:
(4)K2FeO4-Zn碱性电池反应为 2K2FeO4+3Zn+8H2O═2Fe(OH)3+3Zn(OH)2+4KOH则正极的电极反应式是
(5)K2FeO4常含有Na2FeO4杂质.取样品w g,测得Fe的物质的量为n mol,则该样品中K2FeO4的物质的量为
考点:原子结构与元素的性质,氧化还原反应,热化学方程式,化学电源新型电池
专题:基本概念与基本理论
分析:(1)Fe位于周期表第4周期Ⅷ族,N的核外电子排布为1s22s22p3,S的原子序数为16,核外电子排布为1s22s22p63s23p4;
(2)NH3可用来消除NO的污染,生成2种对环境无害的物质,应生成氮气和水;
(3)计算出硫的物质的量,可计算出1molS燃烧放出的热量,进而书写热化学方程式;
(4)正极K2FeO4被还原生成Fe(OH)3;
(5)假设K2FeO4、Na2FeO4分别为xmol、ymol,根据质量和物质的量关系列式计算.
(2)NH3可用来消除NO的污染,生成2种对环境无害的物质,应生成氮气和水;
(3)计算出硫的物质的量,可计算出1molS燃烧放出的热量,进而书写热化学方程式;
(4)正极K2FeO4被还原生成Fe(OH)3;
(5)假设K2FeO4、Na2FeO4分别为xmol、ymol,根据质量和物质的量关系列式计算.
解答:
解:(1)Fe位于周期表第4周期Ⅷ族,N的核外电子排布为1s22s22p3,则原子有3个未成对电子,S的原子序数为16,核外电子排布为1s22s22p63s23p4,
故答案为:第4周期Ⅷ族;3;1s22s22p63s23p4;
(2)NH3可用来消除NO的污染,生成2种对环境无害的物质,应生成氮气和水,反应的方程式为4NH3+6NO
5N2+6H2O,反应中只有N元素化合价发生变化,由方程式可知反应中氧化产物与还原产物的物质的量之比为4:6=2:3,故答案为:4NH3+6NO
5N2+6H2O;2:3;
(3)n(S)=
=0.5mol,则1molS完全燃烧放出的热量为148.5kJ×2=297kJ,则热化学方程式为S(s)+O2(g)=SO2(g);△H=-297kJ/mol,
故答案为:S(s)+O2(g)=SO2(g);△H=-297kJ/mol;
(4)正极K2FeO4被还原生成Fe(OH)3,电极反应式为FeO42-+3e-+4H2O═Fe(OH)3+5OH-,故答案为:FeO42-+3e-+4H2O═Fe(OH)3+5OH-;
(5)假设K2FeO4、Na2FeO4分别为xmol、ymol,
则
,
解之得x=
,
故答案为:
.
故答案为:第4周期Ⅷ族;3;1s22s22p63s23p4;
(2)NH3可用来消除NO的污染,生成2种对环境无害的物质,应生成氮气和水,反应的方程式为4NH3+6NO
| ||
| △ |
| ||
| △ |
(3)n(S)=
| 16g |
| 32g/mol |
故答案为:S(s)+O2(g)=SO2(g);△H=-297kJ/mol;
(4)正极K2FeO4被还原生成Fe(OH)3,电极反应式为FeO42-+3e-+4H2O═Fe(OH)3+5OH-,故答案为:FeO42-+3e-+4H2O═Fe(OH)3+5OH-;
(5)假设K2FeO4、Na2FeO4分别为xmol、ymol,
则
|
解之得x=
| w-166n |
| 32 |
故答案为:
| w-166n |
| 32 |
点评:本题考查较为综合,涉及多方面的知识,为高考常题型和高频考点,侧重于学生的分析能力和计算能力的考查,注意相关知识的积累,难度中等.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
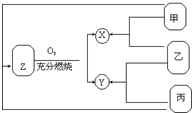 有甲、乙、丙三种常见单质,在一定条件下可按如图关系转化为X、Y、Z三种常见的化合物.问:
有甲、乙、丙三种常见单质,在一定条件下可按如图关系转化为X、Y、Z三种常见的化合物.问: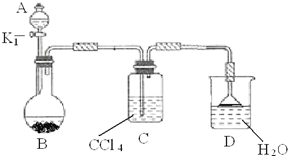 以下为苯的取代反应的探究实验.
以下为苯的取代反应的探究实验.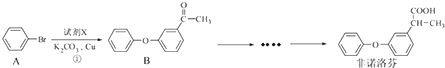
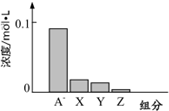 常温下,0.2mol/L 的一元酸 HA 与等浓度的 NaOH 溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示.请回答下列问题:
常温下,0.2mol/L 的一元酸 HA 与等浓度的 NaOH 溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示.请回答下列问题: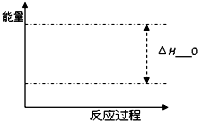 甲醇是一种重要的化工原料.
甲醇是一种重要的化工原料.