题目内容
(1)38g某二价金属氯化物(ACl2)中含有0.8mol Cl-,则ACl2的摩尔质量是 ;A的相对原子质量是 ;ACl2的化学式是 .
(2)质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水.得到的溶液每亳升质量为q g,物质的量浓度为c.则溶质的相对分子质量为 .
(2)质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水.得到的溶液每亳升质量为q g,物质的量浓度为c.则溶质的相对分子质量为
考点:物质的量的相关计算,溶液中溶质的质量分数及相关计算
专题:计算题
分析:(1)根据n=
计算;
(2)首先求蒸发掉Pg水后溶质质量分数为:
,再根据c=
的公式变形计算溶质的相对分子质量.
| m |
| M |
(2)首先求蒸发掉Pg水后溶质质量分数为:
| ma+nb |
| m+n-p |
| 1000ρω |
| M |
解答:
解:(1)38g某二价金属氯化物(ACl2)中含有0.8mol Cl-,则n(ACl2)=0.4mol,M(ACl2)=
=95g/mol,A的相对原子质量为95-2×35.5=24,应为MgCl2,
故答案为:95g/mol;24;MgCl2;
(2)发掉Pg水后溶质质量分数为:
,
根据c=
可知,溶质的摩尔质量M=
=
g/mol=
g/mol.
所以溶质的相对分子质量为
.
故答案为:
.
| 38g |
| 0.4mol |
故答案为:95g/mol;24;MgCl2;
(2)发掉Pg水后溶质质量分数为:
| ma+nb |
| m+n-p |
根据c=
| 1000ρω |
| M |
| 1000ρω |
| c |
1000×q×
| ||
| c |
| 1000q(am+nb) |
| c(m+n-p) |
所以溶质的相对分子质量为
| 1000q(am+nb) |
| c(m+n-p) |
故答案为:
| 1000q(am+nb) |
| c(m+n-p) |
点评:本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,本题注意把握计算的思路和相关计算公式的运用,难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
下列有关说法正确的是( )
| A、丁达尔现象不是胶体特有的,溶液也具备 |
| B、欲配制1.00 L 1.00 mol?L-1的NaCl溶液,可将58.5g NaCl溶于1.00 L水中 |
| C、质子数为53,中子数为78的碘原子可表示为:131 53I |
| D、煤的干馏和石油的分馏均属化学变化 |
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A、0.1mol?L-1的NH4Cl溶液C(Cl-)>C(NH4+)>C(OH-)>C(H+) |
| B、0.1mol?L-1的(NH4)2SO4溶液中:C(NH4+)=2 C(SO42-) |
| C、0.2mol?L-1的Na2CO3溶液中:C(OH-)=C(HCO3-)+C(H+)+C(H2CO3) |
| D、C(NH4+)相等的NH4HSO4溶液,NH4HCO3溶液和NH4Cl溶液中,C(NH4H SO4)<C( NH4Cl)<C(NH4HCO3) |
2011年3月11日,日本本州岛仙台港发生9.0级地震,地震引发海啸、食盐、蔗糖、醋酸、“84消毒液”、明矾等是灾后居民日常生活中经常使用的物质,下列有关说法或表示正确的是( )
A、食盐中阴离子的结构示意图为: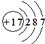 |
| B、蔗糖和醋酸都是弱电解质 |
C、“84消毒液”中有效成分NaClO的电子式为: |
| D、明矾溶液水解可制得Al(OH)3胶体,用于杀菌消毒 |
 B.
B.
 D.
D.