题目内容
 甲醇是一种重要的化工原料.
甲醇是一种重要的化工原料.甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景.现有如下实验,在体积为1L的密闭容器中,充入1mol CH3OH和1molH2O,一定条件下发生反应:CH3OH (g)+H2O (g)?CO2(g)+3H2(g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示.
| 时间 物质 | 0min | 10min | 30min | 60min | 70min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则甲醇与水蒸气催化重整反应的焓变△H3=
(2)10~30min内,氢气的平均反应速率v(H2)=
(3)下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.再充入1molH2O(g)
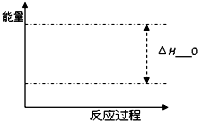
(4)根据题目有关信息,请在坐标图中标示出该甲醇与水蒸气催化重整反应过程的能量变化(标明信息).
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.已知该燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,该电池中负极上的电极反应式是:2CH3OH-12e-+16OH-=2CO32-+12H2O,则正极上发生的电极反应为:
考点:化学平衡的影响因素,反应热和焓变,化学电源新型电池
专题:基本概念与基本理论
分析:(1)依据热化学方程式和盖斯定律计算得到所需热化学方程式得到反应焓变;
结合平衡常数概念书写反应的平衡常数表达式计算得到K3和K1、K2的关系;
(2)依据反应速率概念计算,v=
计算得到二氧化碳的反应速率,结合反应速率之比等于化学方程式计量数之比计算得到氢气反应速率;
(3)为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量;
(4)根据该反应放热,生成物的总能量小于反应物的总能量,△H<O;
(5)根据正极的电极反应=总反应-负极的电极反应.
结合平衡常数概念书写反应的平衡常数表达式计算得到K3和K1、K2的关系;
(2)依据反应速率概念计算,v=
| △c |
| △t |
(3)为使甲醇与二氧化碳的物质的量比值增大,应使平衡向正反应方向移动,或增加甲醇的物质的量;
(4)根据该反应放热,生成物的总能量小于反应物的总能量,△H<O;
(5)根据正极的电极反应=总反应-负极的电极反应.
解答:
解:(1)①CH3OH (g)+
O2 (g)?CO2(g)+2H2(g)?H1=-192.9kJ/mol K1
②H2(g)+
O2(g)?H2O(g)?H2=-120.9kJ/mol K2
结合盖斯定律计算①-②得到甲醇与水蒸气催化重整反应的热化学方程式为:CH3OH (g)+H2O (g)?CO2(g)+3H2(g),△H3=-72KJ/mol;
K1=
K2=
K3=
=
;
故答案为:-72.0kJ/mol; K3=
;
(2)10~30min内,二氧化碳的反应速率v(CO2)=
=0.02mol/L?min,氢气的平均反应速率v(H2)=3v(CO2)=0.06mol/L?min;
故答案为:0.06 mol/(L?min);
(3)CH3OH (g)+H2O (g)?CO2(g)+3H2(g),反应是气体体积增大的反应;
A、加入催化剂,平衡向不发生移动,甲醇与二氧化碳的物质的量比值不变,故A错误;
B、恒容充入He(g),使体系压强增大,分压不变,对反应物质没有影响,平衡不移动,二者比值不变,故B错误;
C、将H2(g)从体系中分离,生成物的浓度减小,平衡向正反应方向移动,二者比值变大,故C正确;
D、再充入1mol H2O,平衡向正方向移动,甲醇浓度增大,二者比值增大,故D正确.
故答案为:CD;
(4)该反应放热,生成物的总能量小于反应物的总能量,△H<O,图象为: ;
;
故答案为: ;
;
(5)燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,负极上的电极反应式是:2CH3OH-12e-+16OH-=2CO32-+12H2O,两式相减,正极上的电极反应式是:3O2+12H2O+12e-=12OH-,所以正极上发生的电极反应为O2+2H2O+4e-=4OH-;
故答案为:O2+2H2O+4e-=4OH-;
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
结合盖斯定律计算①-②得到甲醇与水蒸气催化重整反应的热化学方程式为:CH3OH (g)+H2O (g)?CO2(g)+3H2(g),△H3=-72KJ/mol;
K1=
| c(CO2)c2(H2) | ||
c(CH3OH)c
|
K2=
| c(H2O) | ||
c(H2)c
|
K3=
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| K1 |
| K2 |
故答案为:-72.0kJ/mol; K3=
| K1 |
| K2 |
(2)10~30min内,二氧化碳的反应速率v(CO2)=
| 0.6mol/L-0.2mol/L |
| 30min-10min |
故答案为:0.06 mol/(L?min);
(3)CH3OH (g)+H2O (g)?CO2(g)+3H2(g),反应是气体体积增大的反应;
A、加入催化剂,平衡向不发生移动,甲醇与二氧化碳的物质的量比值不变,故A错误;
B、恒容充入He(g),使体系压强增大,分压不变,对反应物质没有影响,平衡不移动,二者比值不变,故B错误;
C、将H2(g)从体系中分离,生成物的浓度减小,平衡向正反应方向移动,二者比值变大,故C正确;
D、再充入1mol H2O,平衡向正方向移动,甲醇浓度增大,二者比值增大,故D正确.
故答案为:CD;
(4)该反应放热,生成物的总能量小于反应物的总能量,△H<O,图象为:
 ;
;故答案为:
 ;
;(5)燃料电池的总反应式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,负极上的电极反应式是:2CH3OH-12e-+16OH-=2CO32-+12H2O,两式相减,正极上的电极反应式是:3O2+12H2O+12e-=12OH-,所以正极上发生的电极反应为O2+2H2O+4e-=4OH-;
故答案为:O2+2H2O+4e-=4OH-;
点评:本题主要考查化学反应速率、平衡图象、化学平衡常数、平衡状态的判断、电极反应方程式等,难度中等,注意基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A、0.1mol?L-1的NH4Cl溶液C(Cl-)>C(NH4+)>C(OH-)>C(H+) |
| B、0.1mol?L-1的(NH4)2SO4溶液中:C(NH4+)=2 C(SO42-) |
| C、0.2mol?L-1的Na2CO3溶液中:C(OH-)=C(HCO3-)+C(H+)+C(H2CO3) |
| D、C(NH4+)相等的NH4HSO4溶液,NH4HCO3溶液和NH4Cl溶液中,C(NH4H SO4)<C( NH4Cl)<C(NH4HCO3) |
下列离子方程式书写正确的是( )
| A、铝单质与NaOH溶液反应:2Al+2OH-=2AlO2-+3H2↑ |
| B、醋酸溶液与NaHCO3溶液反应:H++HCO3-=CO2↑+H2O |
| C、SO2通入溴水中:SO2+Br2+H2O=SO42-+2Br-+2H+ |
| D、铁溶于过量稀硝酸中:Fe+4H++NO3-=Fe3++NO↑+2H2O |