题目内容
有甲乙两种金属的混合物5.4g,与足量盐酸反应后生成标准状况下的氢气10.08L,同时分别生成+2价和+3价的金属盐酸盐.已知乙元素相对原子质量为甲元素相对原子质量的3倍,而原混合物中,甲乙两种金属的原子个数比为3:1.又知甲乙两种元素原子核内中子数均比质子数多1.试通过计算确定甲乙各是什么金属.
考点:有关混合物反应的计算
专题:计算题
分析:令甲的相对原子质量为a,则乙的相对原子质量为3a,设乙的物质的量为b mol,则甲的物质的量为3b mol,根据二者质量及电子转移守恒列方程计算,再根据元素原子核内中子数均比质子数多1计算质子数,进而确定元素.
解答:
解:10.08L氢气的物质的量=
=0.45mol,
令甲的相对原子质量为a,则乙的相对原子质量为3a,设乙的物质的量为b mol,则甲的物质的量为3b mol,
根据二者质量之和,可得:3ab+3ab=5.4,故ab=0.9
根据电子转移守恒,可得:3b×2+b×3=0.45×2,解得b=0.1,
联立可得,a=9,
故乙的相对原子质量=3a=27,
甲乙两种元素原子核内中子数均比质子数多1,则:甲的质子数=
=4,故甲为Be,乙的质子数=
=13,故乙为Al,
答:甲为Be,乙为Al.
| 10.08L |
| 22.4L/mol |
令甲的相对原子质量为a,则乙的相对原子质量为3a,设乙的物质的量为b mol,则甲的物质的量为3b mol,
根据二者质量之和,可得:3ab+3ab=5.4,故ab=0.9
根据电子转移守恒,可得:3b×2+b×3=0.45×2,解得b=0.1,
联立可得,a=9,
故乙的相对原子质量=3a=27,
甲乙两种元素原子核内中子数均比质子数多1,则:甲的质子数=
| 9-1 |
| 2 |
| 27-1 |
| 2 |
答:甲为Be,乙为Al.
点评:本题考查元素推断、混合物计算,难度不大,注意利用电子转移守恒解答.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
剧毒物质二恶英,其结构为 ,已知它的二氯代物有10种,则其六氯代物有( )
,已知它的二氯代物有10种,则其六氯代物有( )
 ,已知它的二氯代物有10种,则其六氯代物有( )
,已知它的二氯代物有10种,则其六氯代物有( )| A、15种 | B、11种 |
| C、10种 | D、5种 |
 已知图中H是常见无色液体,B是空气中含量最多的物质,A和B要在高温高压才能合成C,F是一种强酸:
已知图中H是常见无色液体,B是空气中含量最多的物质,A和B要在高温高压才能合成C,F是一种强酸: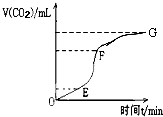 请用相关知识回答下列问题:
请用相关知识回答下列问题: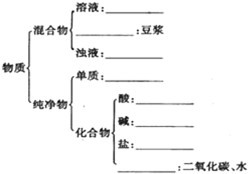 有下列物质:A.豆浆,B.食盐水,C.铁,D.硫酸,E.氢氧化钠固体,F.氯化钠,G.泥水,H.二氧化碳,I.水.请将它们的序号或所属类别填充到如图的横线上.(填写序号)
有下列物质:A.豆浆,B.食盐水,C.铁,D.硫酸,E.氢氧化钠固体,F.氯化钠,G.泥水,H.二氧化碳,I.水.请将它们的序号或所属类别填充到如图的横线上.(填写序号)