题目内容
下列说法正确的是( )
| A、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B、已知AgCl的Ksp=1.8×10-10、Ag2CrO4的Ksp=1.2×10-12,所以相同温度下AgCl的溶解度大于Ag2CrO4 |
| C、常温下,将pH=8的醋酸钠溶液稀释,溶液中所有离子浓度都减小 |
| D、反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 |
考点:金属的电化学腐蚀与防护,反应热和焓变,盐类水解的应用,难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:A、作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护;
B、当化学式相似时,可以直接通过比较Ksp的大小来比较两者溶解度的大小,当化学式不同时,一般不能通过比较Ksp的大小来比较两者溶解度的大小,需通过Ksp的计算;
C、向醋酸钠溶液中加入水促进醋酸钠水解,但溶液的pH减小.
D、根据当△G=△H-T?△S<0时反应能自发进行来判断.
B、当化学式相似时,可以直接通过比较Ksp的大小来比较两者溶解度的大小,当化学式不同时,一般不能通过比较Ksp的大小来比较两者溶解度的大小,需通过Ksp的计算;
C、向醋酸钠溶液中加入水促进醋酸钠水解,但溶液的pH减小.
D、根据当△G=△H-T?△S<0时反应能自发进行来判断.
解答:
解:A.Cu、Fe和电解质溶液构成原电池,Fe易失电子作负极、Cu作正极,所以Fe加速被腐蚀,故A正确;
B、假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=2.0×10-12,x3=4.0×10-12,即x=
,因为AgCl饱和溶液中Ag+的浓度为
,所以Ag2CrO4的溶解度大于AgCl,故B错误;
C、向醋酸钠溶液中加入水促进醋酸钠水解,但溶液的pH减小,氢离子浓度增大,故C错误;
D、当反应的△G=(△H-T?△S)<0时反应能自发进行,根据反应可知,此反应的熵变△S<0,故△H应<0,故D正确.
故选AD.
B、假设Ag2CrO4饱和溶液中Ag+的浓度为x,则CrO42-的浓度为0.5x,由溶度积常数的表达式可知Ksp(Ag2CrO4)=x2×0.5x=0.5x3=2.0×10-12,x3=4.0×10-12,即x=
| 3 | 4.0×10-12 |
| 1.8×10-10 |
C、向醋酸钠溶液中加入水促进醋酸钠水解,但溶液的pH减小,氢离子浓度增大,故C错误;
D、当反应的△G=(△H-T?△S)<0时反应能自发进行,根据反应可知,此反应的熵变△S<0,故△H应<0,故D正确.
故选AD.
点评:本题考查了电化学腐蚀、难溶电解质的Ksp与溶解度的关系和影响盐类水解的因素等问题,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
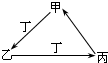 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )| A、若甲为焦炭,则丁可能是O2 |
| B、若甲为Fe,则丁可能是Cl2 |
| C、若甲为AlCl3,则丁可能是NH3 |
| D、若甲为NaHCO3,则丁可能是HCl |
在25℃时,某稀溶液中由水电离产生的c(H+)=10-13mol/L.有关该溶液的叙述正确的是( )
| A、该溶液的pH值可能为1 |
| B、水的电离受到促进 |
| C、水的离子积将变小 |
| D、该溶液的pH值一定为13 |
下列各组烃的混合物,只要总质量一定,按任意比例混合,完全燃烧后生成的CO2和H2O都是恒量的是( )
| A、C2H2、C2H4 |
| B、C2H4、C4H6 |
| C、C2H6、C3H6 |
| D、C6H6、C2H2 |
下列物质中属于电解质的是( )
| A、硫酸钡 | B、氮气 | C、铜 | D、蔗糖 |