题目内容
6.在饱和Mg(OH)2溶液中,c(OH-)=1.0×10-4 mol•L-1.若往该溶液中加入NaOH溶液,使溶液的c(OH-)变为原来的10倍,则Mg(OH)2的溶解度在理论上将( )| A. | 变为原来的10-3倍 | B. | 变为 原来的10-2倍 | ||
| C. | 变为原来的103倍 | D. | 不发生变化 |
分析 饱和Mg(OH)2溶液中c(OH-)=2c(Mg2+),根据Ksp=c(Mg2+)•[c(OH-)]2计算氢氧化镁的溶度积,再计算加入氢氧化钠溶液后溶液中镁离子浓度,结合镁离子浓度计算.
解答 解:饱和Mg(OH)2溶液中c(OH-)=2c(Mg2+)=1.0×10-4 mol/L,故c(Mg2+)=5×10-5 mol/L,则
Ksp[Mg(OH)2]=c(Mg2+)•[c(OH-)]2=5×10-5×(1×10-4 )2=5×10-13,
向该溶液中加入NaOH溶液,使c(OH-)变为原来的10倍,即c′(OH-)=1.0×10-3 mol/L,而溶液中c′(Mg2+)=$\frac{5×1{0}^{-13}}{(1×1{0}^{-3})^{2}}$mol/L=5×10-7 mol/L,则Mg(OH)2的溶解度在理论上将变为原来的$\frac{5×1{0}^{-7}}{5×1{0}^{-5}}$=10-2倍,
故选B.
点评 本题考查溶度积的有关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意溶度积只受温度影响,根据浓度积与溶度积关系理解难溶电解质的溶解、析出与饱和状态.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
18.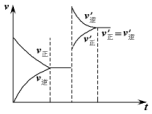 如图表示在密闭容器中反应C(s)+H2O(g)$\stackrel{高温}{?}$CO(g)+H2(g);△H>0,达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况.据图可知,改变的条件是( )
如图表示在密闭容器中反应C(s)+H2O(g)$\stackrel{高温}{?}$CO(g)+H2(g);△H>0,达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况.据图可知,改变的条件是( )
 如图表示在密闭容器中反应C(s)+H2O(g)$\stackrel{高温}{?}$CO(g)+H2(g);△H>0,达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况.据图可知,改变的条件是( )
如图表示在密闭容器中反应C(s)+H2O(g)$\stackrel{高温}{?}$CO(g)+H2(g);△H>0,达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况.据图可知,改变的条件是( )| A. | 增加CO浓度 | B. | 升高温度 | C. | 增加水蒸气 | D. | 增大压强 |
19.食品安全问题备受人们关注,但应该区别违法食品添加剂与正常食品添加剂.做馒头的过程中禁止添加的是( )
| A. | 小苏打 | B. | 增白剂 | C. | 蔗糖 | D. | 食盐 |
11.已知溶液中存在平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)△H<0.下列有关该平衡体系的叙述正确的是( )
| A. | 升高温度,固体的量减少 | |
| B. | 加入少量Na2CO3粉末能增大钙离子的浓度 | |
| C. | 降低温度,溶液中c(OH-)增大 | |
| D. | 恒温下加入少量CaO,溶液的pH增大 |
15.下列说法中正确的是( )
| A. | 标准状况下,22.4L水中所含的分子数约为6.02×1023 | |
| B. | 标准状况下,aL的氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| C. | 常温常压下,48g O3气体含有的氧原子数为6.02×1023 | |
| D. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 |
16.下列说法正确的是( )
| A. | 同一物质的固、液、气三种状态的熵值相同 | |
| B. | NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g);△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
 .
.