题目内容
6.用标准盐酸溶液滴定未知浓度的NaOH溶液,所测数据如下:| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.20 | 20.22 |
| 第二次 | 25.00 | 0.56 | 24.54 |
| 第三次 | 25.00 | 0.42 | 20.40 |
| A. | 0.0853mol/L | B. | 0.1000mol/L | C. | 0.0800mol/L | D. | 0.1250mol/L |
分析 先根据滴定前、滴定后数据计算出每次滴定中消耗盐酸体积,然后判断滴定数据是否有效,将有效的数据取平均值,从而得出消耗标准液体积,然后根据中和反应实质计算出消耗氢氧化钠的物质的量,最后根据c=$\frac{n}{V}$计算出氢氧化钠溶液的浓度.
解答 解:第一次滴定消耗盐酸的体积为:20.22mL-0.20mL=20.02mL,第二次滴定消耗盐酸的体积为:24.54mL-0.56mL=23.98mL,第三次滴定消耗盐酸的体积为:20.40mL-0.42mL=19.98mL,
由于第二次滴定消耗盐酸体积与其它两次数据差别较大,应该舍弃,则其它两次滴定消耗盐酸的平均体积为:$\frac{20.02mL+19.98mL}{2}$=20.00mL,
根据中和反应原理可知:n(NaOH)=n(HCl),
所以测定该氢氧化钠溶液的物质的量浓度为:c(NaOH)=$\frac{n(HCl)}{0.025L}$=$\frac{0.1000×0.02L}{0.025L}$=0.0800mol/L,
故选C.
点评 本题考查了中和滴定的计算,题目难度不大,正确处理滴定数据为解答关键,注意掌握中和滴定操作方法及中和反应实质,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
16.下列离子方程式正确的是( )
| A. | NaHCO3溶液中滴入偏铝酸钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| B. | 饱和碳酸钠溶液中通入过量二氧化碳气体:CO32-+CO2+H2O═2HCO3- | |
| C. | NaHSO3溶液与FeCl3溶液混合溶液颜色变浅:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ | |
| D. | 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
14.下列反应进行分类时(按初中的方法),既属于氧化反应又属于化合反应的是( )
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
1.下列各离子反应方程式书写正确的是( )
| A. | 配制银氨溶液时的总反应:Ag++3NH3•H20═[Ag(NH3)2]OH+NH4++2H20 | |
| B. | 向1 mL 0.l mol/L硝酸亚铁溶液加入1 mL 0.1 mol/L的HI溶液:3 Fe2++N03-+4H+═3 Fe3++NO+2H2O | |
| C. | 向10 mL 0.lmol/L NH4Al(SO4)2溶液中加入0.1 mol/L Ba(OH)2溶液至恰好只有一种沉淀时:NH4++Al3++5OH-+2 SO42-+2Ba2+═AlO2-+NH3•H2O+2H2O+2BaSO4L | |
| D. | 向高锰酸钾酸性溶液中滴加H202溶液,高锰酸钾溶液紫红色褪去:2MnO4-+7H2O2+6H+═2Mn2++6O2+lOH2O |
11.铬及其化合物在工业上有许多用途,但化工废料铬渣对人体健康有很大危害.
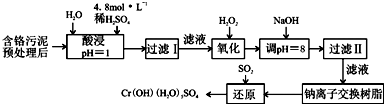
以制革工业产生的污泥为原料,回收污泥中三价铬的工艺流程如图所示,(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+):
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
(1)能提高酸浸时三价铬的浸取率的措施有ABC(填字母)
A.将含铬污泥粉碎并适当延长浸取时间 B.升高温度不断搅拌 C.多次浸取,合并浸取液 D.缩短浸取时间
(2)氧化过程中加入H2O2,除了能把Cr3+氧化为Cr2O72-外,另一个作用是2Fe2++2H++H2O2=2Fe3++2H2O(用离子方程式表示)
(3)过滤Ⅱ产生的沉淀是Fe(OH)3、Al(OH)3、Cu(OH)2,(填化学式)
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+,Mg2+(填离子符号)
(5)每生成1molCr(OH)(H2O)3SO4,消耗SO2的物质的量为1.5mol
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解,经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去
①铁电极与直流电源的正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)3]=6.0×10-31)
以制革工业产生的污泥为原料,回收污泥中三价铬的工艺流程如图所示,(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+):

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
A.将含铬污泥粉碎并适当延长浸取时间 B.升高温度不断搅拌 C.多次浸取,合并浸取液 D.缩短浸取时间
(2)氧化过程中加入H2O2,除了能把Cr3+氧化为Cr2O72-外,另一个作用是2Fe2++2H++H2O2=2Fe3++2H2O(用离子方程式表示)
(3)过滤Ⅱ产生的沉淀是Fe(OH)3、Al(OH)3、Cu(OH)2,(填化学式)
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的杂质离子是Ca2+,Mg2+(填离子符号)
(5)每生成1molCr(OH)(H2O)3SO4,消耗SO2的物质的量为1.5mol
(6)工业上可用电解法处理含Cr2O72-的酸性废水,具体方法是将含Cr2O72-的酸性废水放入电解槽内,加入适量的NaCl,以铁和石墨为电极进行电解,经过一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去
①铁电极与直流电源的正极(填“正极”或“负极”)相连,加入适量NaCl的目的是增大溶液导电能力
②若电解后的溶液中c(Fe3+)为2.0×10-13mol•L-1,则溶液中为3.0×10-6mol/L(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Fe(OH)3]=6.0×10-31)
18.某兴趣小组欲配置一定浓度的NaOH溶液,下列说法不正确的是( )
| A. | 需要配置480mL该溶液,应选用500mL容量瓶 | |
| B. | 固体NaOH须放到烧杯中称量 | |
| C. | 把称好的固体加水溶解后马上转移到容量瓶中 | |
| D. | 定容时俯视刻度线,所配NaOH溶液浓度会偏大 |

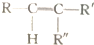 $\stackrel{高锰酸钾酸性溶液}{→}$R-COOH+
$\stackrel{高锰酸钾酸性溶液}{→}$R-COOH+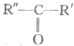
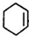 ,HOOC(CH2)4COOH.
,HOOC(CH2)4COOH. 实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过蒸发、结晶得到硫酸铜晶体.
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过蒸发、结晶得到硫酸铜晶体.